Lic. Kelly Turcatti*
RESUMEN
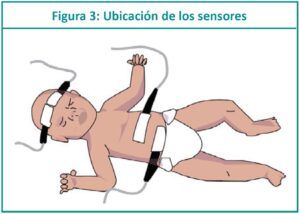
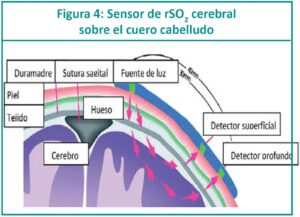
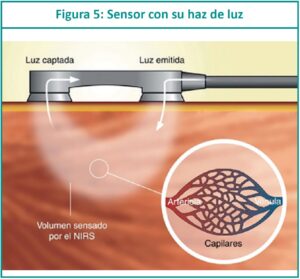
La espectroscopia por infrarrojo cercano es conocida por sus siglas en inglés: NIRS (Near infrared spectroscopy). Es un método no invasivo que mide la saturación regional de oxígeno (rSO2) en diversos órganos y refleja el equilibrio entre el suministro de oxígeno tisular y la demanda. Permite realizar una valoración del estado hemodinámico a través de la perfusión y la oxigenación del cerebro, riñón, hígado, intestino o músculo, dependiendo del sitio donde se coloque el sensor del equipo. Detecta cualquier cambio en la per-fusión de los tejidos y permite adaptar el tratamiento a la necesidad actual del recién nacido (RN). Es una tecnología de fácil aplicación, no invasiva y al tener un tamaño adecuado para el traslado, ofrece una monitorización permanente. Se puede utilizar NIRS desde el ingreso del RN a la unidad de cuidados intensivos neonatales (UCIN); en la medida que avanza el conocimiento sobre su utilidad clínica y los profesionales se familiaricen con su uso, más neonatos requerirán de esta tecnología para mejorar su cuidado.
Palabras clave: Saturación regional de oxígeno, espectroscopia, recién nacido, pretérmino, cuidados de enfermería.
Cómo citar:
Turcatti K. Aplicación de tecnologías al cuidado de enfermería: monitorización de la saturación regional de oxígeno por espectroscopia por infrarrojo cercano. Rev Enferm Neonatal. Agosto 2017;24:3-10.
INTRODUCCIÓN
El empleo de la espectroscopia por infrarrojo cercano (NIRS) se viene utilizando desde hace muchos años para análisis de distintos productos de las industrias de alimentos, química, bioquímica, ambiental, farmacéutica y médica.
William Herschel, astrónomo y músico alemán, descubrió en el año 1800 los rayos infrarrojos y observó que la temperatura variaba para cada color. Así surge la espectroscopia infrarroja y se transforma después de 1890, en una herramienta para la investigación científica.1 A mediados de los años 1950, Wilbur Kaye y Beckman Instruments publicaron dos artículos que ponen a NIRS sobre una base firme, pero su mayor uso comienza en la aplicación industrial, en la segunda mitad del siglo XX, evolucionando la NIRS en las ciencias agrícolas.
Karl Norris del Departamento de Agricultura de Estados Unidos, reconoció el potencial de esta técnica desde las primeras etapas de su desarrollo.
En 1985, Ferrari y col., reportaron las primeras mediciones de oximetría cerebral en humanos usando NIRS.2 En esta última década comenzó a utilizarse como herramienta de cuidado en la clínica médica.1,2