Lic. María Cristina Malerba*
RESUMEN
El recién nacido prematuro de muy bajo peso al nacer (RNPBPN), es inmunológicamente inmaduro y presenta una alteración en las barreras naturales de defensa contra las infecciones.
Uno de los mecanismos naturales de defensa del cuerpo es la saliva, que previene la contaminación oral. Esta función inmune natural puede verse interrumpida en neonatos enfermos, por el uso prolongado de sondas orogástricas y tubos endotraqueales.
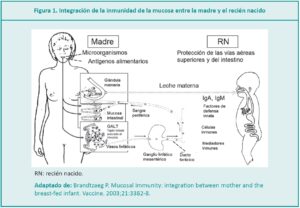
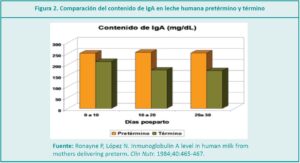
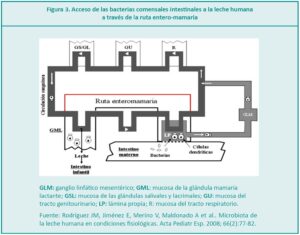
El calostro es el fluido biológico producido por la glándula mamaria después del parto, antes de que modifique gradualmente sus características iniciales y se convierta en leche madura. Proporciona la nutrición de los recién nacidos (RN), protección contra patógenos, promueve el desarrollo del sistema inmunitario, equilibra la flora intestinal y asegura el crecimiento, maduración y reparación de los tejidos. La leche de madres que dieron a luz prematuramente, contiene un nivel mayor de proteínas, inmunoglobulina A (IgA), lactoferrina y menos cantidad de lactosa que la leche de término, lo cual es apropiado para un RN inmaduro.
La obtención de leche materna para los neonatos internados en las unidades de cuidados intensivos neonatales (UCIN), requiere un programa de educación a las madres y apoyo para la extracción y posterior conservación desde el primer día del nacimiento.
En este artículo se van a explorar en dos entregas consecutivas, las propiedades específicas de algunos componentes del calostro y su potencial uso clínico para la reducción de la incidencia de contaminación con cepas de microorganismos resistentes y bacterias patógenas en el intestino de neonatos de riesgo, y como barrera contra las infecciones respiratorias.
Palabras clave: recién nacido prematuro, inmunología, microbiota, calostro, leche humana, saliva, flora intestinal.
Cómo citar:
Malerba C. Uso de calostro como terapia inmunológica en recién nacidos prematuros. Primera parte. Rev Enferm Neonatal. Diciembre 2017;25:3-10.
INTRODUCCIÓN:
Los recién nacidos (RN) que nacen prematuros comienzan su vida con una desventaja inmunológica en comparación con los neonatos de término, que reciben anticuerpos maternos transferidos a través de la placenta durante las últimas etapas del embarazo. Los recién nacidos prematuros (RNPT) también son propensos a una colonización intestinal anormal, como resultado del uso rutinario de antibióticos al nacer o debido a que, en algunas UCIN, no se administra leche humana (LH) a pesar de los beneficios avalados por la sólida evidencia disponible. El riesgo aumenta también por el predominio de nacimientos por cesárea y la hospitalización prolongada.
Estos factores sitúan a los prematuros en una desventaja ante los gérmenes patógenos y de alto riesgo de enfermedades inflamatorias inmunes, tanto en el período neonatal temprano como más tarde en la vida. La exposición a los factores inmunológicos encontrados en la leche materna ha demostrado contribuir al desarrollo de una respuesta inmune óptima en el prematuro y superar algunas de las deficiencias de la función inmune innata.
El sistema inmune innato está constituido por barreras físicoquímicas, además de mecanismos inespecíficos como fagocitosis, inflamación, proteínas de fase aguda, sistema del complemento, células natural killer (NK) y células dendríticas. La inmunidad innata tiene un papel fundamental durante los primeros días de vida del neonato prematuro, mientras el sistema inmune adaptativo se desarrolla a través de la interacción del medio con la superficie de las mucosas.1
En esta etapa, en el cuidado del RNPT se utiliza la humidificación del microambiente, con manipulación estéril y controlada. El sistema inmunitario innato tiene un desarrollo inmaduro que se expresa en una eliminación inadecuada de la infección bacteriana y en un reclutamiento anormal de células inmunitarias en el lugar en donde se presenta la infección o inflamación, llegando a producir daño en el tejido huésped.2 Esta primera respuesta innata no guarda memoria frente a los agentes patógenos.
La inmunidad adquirida o adaptativa, en cambio, tiene respuestas más lentas que la innata frente a los agresores, pero presenta dos ventajas: el reconocimiento específico del antígeno, y la memoria que permite una rápida recuperación de la respuesta inicial a la exposición de dicho antígeno. Es aquí donde los resultados tendrán relación directa con la calidad del cuidado que reciba este neonato en la Unidad.
Estos conceptos permitirán relacionar estas limitaciones descriptas del sistema inmune prematuro, con los beneficios que la LH, y en particular el uso del calostro como tópico en la orofaringe, pueda aportar a nivel sistémico. En primer lugar, se destaca la modalidad de alimentación y la elección de la leche.
El feto ingiere líquido amniótico que contiene factores de crecimiento, electrolitos y proteínas. Una vez producido el nacimiento prematuro, esta nutrición enteral se detiene y esto podría disminuir la integridad estructural y funcional, mediante la disminución de la actividad hormonal, afectar el crecimiento de la mucosa intestinal, la actividad de la lactasa, la absorción de nutrientes y/o la maduración motora.
La estimulación enteral trófica o alimentación enteral mínima (AEM), se define como la administración de leche materna o fórmula, en cantidades no significativas para el crecimiento y sostenida por varios días.1 Los beneficios de la AEM en la función intestinal son con-tundentes. Los RN que reciben esta modalidad de alimentación, tienen un tiempo de tránsito intestinal más rápido y mejores patrones de motilidad gastrointestinal (GI) que se traducen clínicamente en mejor tolerancia y más rápido alcance a la alimentación enteral total.3