Dra. Tatiana Orden*, Dr. Juan Pablo Berazategui**
RESUMEN
La espectroscopía cercana al infrarrojo (NIRS por su sigla en inglés) es una técnica no invasiva para monitorizar la oxigenación cerebral; brinda un panorama del estado metabólico y hemodinámico de sitios de interés.
Mediante NIRS podemos valorar de modo no invasivo, el grado de saturación de la hemoglobina en una determinada área, lo que constituye un reflejo del balance entre el aporte y la demanda de oxígeno de los tejidos.
La saturación regional de oxígeno cerebral representa la saturación de oxígeno en la sangre que circula a través de vasos de intercambio venosos y arteriales de < 100 micrones de diámetro, en los que el flujo sanguíneo procede de las venas aproximadamente en un 70-80 %, de los capilares en un 5 % y de las arterias en un 20-25 %.
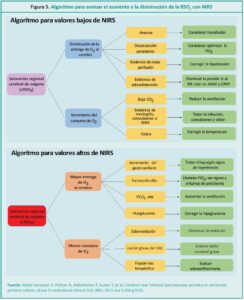
La tecnología NIRS aporta información de la oxigenación cerebral y del flujo sanguíneo cerebral y permite detectar cualquier cambio agudo en la hemodinámica cerebral de forma continua.
Palabras clave: NIRS, recién nacido, saturación regional cerebral de oxígeno.
ABSTRACT
Near infrared spectroscopy (NIRS) is a non-invasive t-chnique for monitoring brain oxygenation; provides an overview of the metabolic and hemodynamic status of sites of interest.
Using NIRS, we can non-invasively assess the degree of hemoglobin saturation in a given area, which is a reflection of the balance between the oxygen supply and demand of the tissues.
The regional cerebral oxygen saturation represents the oxygen saturation in the blood that circulates through venous and arterial exchange vessels < 100 microns in diameter, in which the blood flow comes from the veins in approximately 70-80 %, capillaries by 5 % and arteries by 20-25 %.
NIRS technology provides information on cerebral oxygenation and cerebral blood flow and allows any acute changes in cerebral hemodynamics to be detected continuously.
Key words: NIRS, newborn, regional cerebral oxygen saturation.
Palabras clave: NIRS, newborn, regional cerebral oxygen saturation.
Cómo citar:
Orden T, Berazategui JP. Monitorización de la saturación regional de oxígeno en neonatología. Rev Enferm Neonatal. Agosto 2021;36:18-25.
Siglas y abreviaturas
NIRS: espectroscopía cercana al infrarrojo (near infrared spectroscopy).
Hb: desoxihemoglobina.
HbO2: oxihemoglobina.
nm: nanómetro.
cRSO2: saturación regional de oxígeno cerebral.
SpO2: saturación parcial de oxígeno arterial.
CFTOE: extracción tisular cerebral fraccional de oxígeno.
FSC: flujo sanguíneo cerebral.