Esp. Paulo Damián Arnaudo*, Esp. María Luisa Videla Balaguer**
RESUMEN
El artículo es la tercera parte de una serie destinada a conocer las modalidades ventilatorias invasivas más utilizadas en la actualidad. En esta oportunidad, se describe la ventilación de alta frecuencia (VAF), modalidad única, que se caracteriza principalmente por trabajar a niveles suprafisiológicos y ofrecer un volumen tidal bajo. La VAF se utiliza con fines preventivos, terapéuticos y/o de rescate ante diversas afecciones respiratorias del recién nacido. Sus objetivos son específicos y se dirigen principalmente a evitar la hipoxemia y la acidosis, y disminuir la posible lesión pulmonar que ocasionaría, en determinados casos, la ventilación mecánica convencional para lograr los mismos objetivos.
Conocer los mecanismos de acción de la VAF, sus parámetros únicos y los cuidados prioritarios son materia imprescindible para la enfermería neonatal intensivista.
Palabras clave: recién nacido, cuidado intensivo neo-natal, modos ventilatorios, ventilación de alta frecuencia.
ABSTRACT
The article is the third part of a series aimed at learning about the most widely used invasive ventilatory modalities today. This time, high-frequency ventilation (HFV) is described, a single modality, which is mainly characterized by working at supraphysiological levels and offering a low tidal volume. HFV is used for preventive, therapeutic and/or rescue purposes in various respiratory conditions of the newborn. Its objectives are specific and are mainly aimed at avoiding hypoxemia and acidosis, and reducing the possible lung injury that would be caused, in certain cases, by conventional mechanical ventilation to achieve the same objectives.
Knowing the mechanisms of action of HFV, its unique parameters and priority care are essential matters for nurses and neonatal intensive care nurses.
Keywords: ewborn, neonatal intensive care, ventilato-ry modes, high frequency ventilation.
Cómo citar:
Arnaudo PD, Videla Balaguer ML. Introducción a la ventilación mecánica neonatal invasiva. Parte III. Ventilación de alta frecuencia. Rev Enferm Neonatal. 2022;38:6-13.
INTRODUCCIÓN:
La ventilación de alta frecuencia (VAF) es un nuevo modo de terapia ventilatoria que se utilizó en forma experimental a fines de la década de los 80’ y en los últimos años se ha difundido en diferentes servicios de neonatología, en el tratamiento de recién nacidos (RN) con insuficiencia respiratoria y otras patologías.
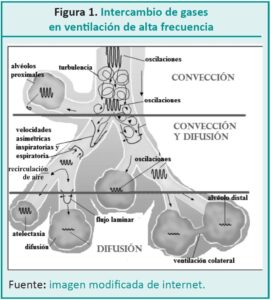
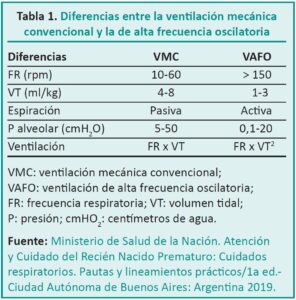
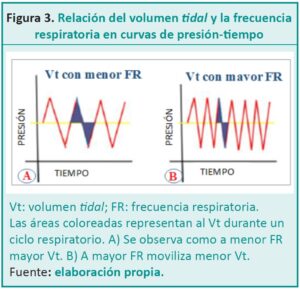
En inglés, la VAF, es denominada high-frequency positive pressure ventilation (HFPPV). Su nombre especifica que el modo ofrece control de la presión. Permite programar la presión media en la vía aérea (MAP) igual o superior a las otorgadas en la ventilación mecánica convencional (VMC), pero sin cambios bruscos entre la presión inspiratoria máxima (PIM) o de fin de expiración (PEEP). La MAP es constante y a través de una frecuencia respiratoria (FR) elevada y un volumen tidal (Vt) bajo logra la ¨apertura del pulmón¨, favorece la ventilación (eliminación de CO2) y la oxigenación.
De esta manera, se infiere que el objetivo principal es reclutar alvéolos y mantener la apertura del pulmón en una zona de seguridad, para evitar la sobredistención y la lesión pulmonar.
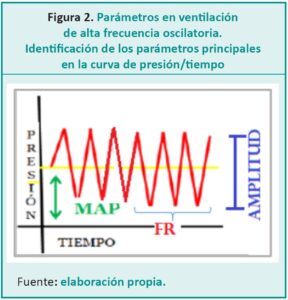
Para comenzar a desarrollar todos los conceptos es necesario conocer que los parámetros son únicos e independientes. Estos son la MAP, la amplitud o delta P, la FR y la fracción inspirada de oxígeno (FiO2). A diferencia de otros modos ventilatorios, la FR se mide en Hertz (Hz). Un Hz es una revolución por segundo; cada minuto son 60 revoluciones o sea 60 ciclos respiratorios por minuto.