Bibiana Chinea Jiménez, PNP, PhD.* Miguel Sáenz de Pipaón Marcos, MD, PhD.**
Importancia de la leche humana y sus características nutricionales. Efectos a corto, medio y largo plazo
RESUMEN
La leche humana es la forma más natural y aconsejable de apoyar el crecimiento y desarrollo de los recién nacidos. Las estrategias de alimentación son de importancia crítica en el manejo de los recién nacidos prematuros.
Los niños dados de alta con lactancia materna exclusiva o parcial presentan menor estancia hospitalaria que aquellos que recibieron lactancia artificial. Además, los que reciben leche materna exclusiva son dados de alta con menor edad posmenstrual.
Los recién nacidos de muy bajo peso de nacimiento necesitan un tiempo similar para lograr la tolerancia enteral completa cuando la leche materna se suplementa con el uso de leche de donantes fortificada o fórmula para prematuros.
El peso y la longitud en el momento del alta son inferiores con leche humana exclusiva. La alimentación con leche de la propia madre durante el ingreso inicial debe ser fomentada porque puede mejorar el neurodesarrollo a los 5 años de edad.
Palabras clave: leche humana, recién nacido prematuro, neurodesarrollo, crecimiento.
ABSTRACT
Human milk is the most natural and desirable way to support the growth and development of newborns. Feeding strategies are critically important in the management of preterm infants.
Children discharged with exclusive or partial breastfeeding have a shorter hospital stay than those who received artificial breastfeeding. In addition, those who receive exclusive breast milk are discharged with a lower postmenstrual age.
Very low birth weight newborns require a similar time to achieve full enteral tolerance when breast milk is supplemented with fortified donor milk or preterm formula.
Weight and length at discharge are lower with exclusive human milk. Feeding the mother’s own milk during the initial admission should be encouraged because it can improve neurodevelopment at 5 years of age.
Keywords: human milk, premature newborn, neurodevelopment, growth.
Cómo citar:
Chinea Jiménez B, Sáenz de Pipaón Marcos M. Importancia de la leche humana y sus características nutricionales. Efectos a corto, medio y largo plazo. Rev Enferm Neonatal. Diciembre 2020;34:33-40.
INTRODUCCIÓN
A pesar de los avances en el cuidado neonatal realizados históricamente, la preocupación acerca de la nutrición y la repercusión que tiene la misma en la evolución clínica es hoy por hoy, uno de los pilares a desarrollar en Neonatología. El estado nutricional juega un rol importante en la prevención de complicaciones durante el periodo neonatal y en el seguimiento de estos pacientes.1
En esta área, la enfermería debe cobrar un especial protagonismo, ya que constituye un cuidado y una necesidad básica de los pacientes. La lactancia materna es una de las formas más eficaces de asegurar la salud y la supervivencia de los niños, y reducir la mortalidad infantil. La leche materna (LM) presenta anticuerpos que protegen de enfermedades como la diarrea y la neumonía, dos de las principales causas de muerte en la infancia en todo el mundo, y favorece un pronto restablecimiento. También promueve el desarrollo sensorial y cognitivo.
Además, la LM propicia una buena salud durante toda la vida, disminuye la tendencia a sufrir sobrepeso u obesidad y la incidencia de diabetes tipo 2.2
La LM contiene los nutrientes esenciales necesarios para un crecimiento y desarrollo saludables. Es el primer alimento natural, proporciona toda la energía y los nutrientes que se necesitan durante los primeros meses de vida y sigue aportando al menos la mitad de las necesidades nutricionales durante la segunda mitad del primer año y hasta un tercio durante el segundo año de vida.
Por ello, la Organización Mundial de la Salud recomienda la LM exclusiva durante seis meses, la introducción de alimentos apropiados para la edad y seguros, a partir de entonces, y el mantenimiento de la lactancia materna hasta los 2 años o más.2
DESARROLLO
La leche humana (LH) tiene tres funciones potenciales en los recién nacidos pretérminos (RNPT):
• Modulación inmunológica. El RNPT sufre diversos efectos cuando nace: un gran número nace por cesárea, por lo que no se benefician de la colonización del canal del parto, ni de la colonización del contacto piel a piel en las primeras horas, se ven so metidos a técnicas invasivas por múltiples profesionales, expuesto a colonizaciones ajenas y frecuentemente con tratamiento antibiótico por el riesgo de sepsis. Esto modifica la microbiota y predispone a la translocación bacteriana y a un estado proinflamatorio en el intestino. Cuanto antes se administre leche humana, más probabilidades hay de evitar la colonización patógena.
• Cebado mecánico y bioquímico del intestino. La LM contiene numerosos factores de crecimiento, algunos de los cuales tienen efectos directos sobre el intestino, como la maduración y reparación de la mucosa, el desarrollo del sistema nervioso enteral y la regulación vascular.
• Provisión de nutrientes. Si la acumulación de nutrientes y el crecimiento intrauterino se toman como el estándar de oro, la leche humana es deficiente como único alimento para los RNPT. Será necesario en numerosas ocasiones aportar nutrición parenteral o la fortificación de la leche materna.3
El crecimiento durante la primera infancia es un pará metro fundamental de la salud, que sirve como indicador de la salud general del lactante, cuya continua evolución desde la concepción hasta el final de la pubertad, tendrá consecuencias durante toda la vida.
Después del parto prematuro, la mayoría de los recién nacidos de muy bajo peso (RNMBP) presenta un patrón de crecimiento postnatal de características bastantes homogéneas: pérdida inicial de peso, recuperación del peso de nacimiento y posterior recanalización.4
Cuando un RN nace prematuramente, el aporte de nutrientes que sustenta su crecimiento durante su vida intrauterina se ve bruscamente interrumpido. El aporte de nutrientes debe restaurarse lo antes posible para asemejarse al crecimiento fetal. Uno de los elementos claves es la nutrición parenteral, que debe iniciarse en las primeras horas de vida.5
En un estudio realizado por Morisaki et al., se demuestra como los RNPT que reciben nutrición parenteral tienen una mayor ganancia de peso y perímetro cefálico.6
La LM se asocia con un aumento de la capacidad cognitiva y de la materia blanca. Se constata la importancia de la LM y la influencia de su efecto beneficioso sobre el cerebro y los vasos arteriales; se sugiere que los factores no nutritivos, como el factor de crecimiento endotelial vascular, pueden desempeñar un papel importante en el desarrollo vascular cerebral.
Aunque existen limitaciones en los estudios, los datos sugieren un posible efecto protector de la alimentación con LM de la propia madre durante cortos periodos de tiempo sobre el neurodesarrollo, dependiente del volumen y la duración.7 El efecto de la alimentación con LM exclusiva a largo plazo ha sido escasamente estudiado.8
El manejo nutricional del RNPT afecta a su morbilidad. La evidencia disponible sugiere una reducción en la incidencia de varias morbilidades asociadas a la prematuridad cuando se utiliza leche humana, como la enterocolitis necrotizante, sepsis, retinopatía, desarrollo anormal del cerebro, síndrome metabólico, obesidad y reingresos.3
Debido a la condición de prematuros, reflejos como el de succión, deglución y coordinación con la respiración, que se involucran y son necesarios a la hora de realizar una correcta técnica de amamantamiento, aún no están presentes, o no están bien desarrollados. Esto dificulta que la madre presente una estimulación temprana y continua necesaria para una correcta producción láctea.
Además, si se suma que el vínculo madre-hijo en las primeras horas se dificulta debido al ingreso a la unidad, el inicio natural de la lactancia se ve interrumpido.
También, hay que tener en cuenta la situación de estrés que vive la madre, que puede influir en el sistema hormonal que condiciona la producción de LM: adrenalina y cortisol, que ejercen un efecto inhibidor en la oxitocina, cuya función es expulsar la leche del alvéolo y facilitar su drenaje al exterior.
Otro factor a tener en cuenta es el tipo de parto. La gran mayoría de los RNPT nacen mediante cesárea, lo cual retrasa la subida de la leche. La razón no es clara, pero apuntaría más a los procedimientos hospitalarios que se llevan a cabo en esta situación (separación del binomio madre-hijo para la recuperación materna, dificultades por molestias tras la cirugía para una correcta prendida) que al propio hecho de la cesárea como tal.
Es aquí donde es necesario intervenir para evitar el fracaso. Prácticamente todas las mujeres pueden amamantar, siempre que dispongan de buena información, del apoyo de su familia y del sistema de atención de salud.9
DISCUSIÓN
En un estudio realizado por Chinea Jiménez y col., en el Hospital La Paz (Madrid, España)10 en 152 RN menores de 1500 g, a los cuales se les hizo seguimiento durante 5 años, se observó que los niños que fueron dados de alta con lactancia materna exclusiva o parcial presentaron menor estancia hospitalaria que aquellos que recibieron lactancia artificial. En un análisis multivariante corrigiendo por edad gestacional y peso del RN, se mantienen las diferencias entre los grupos (Tabla 1). Además, los niños alimentados con LM exclusiva son dados de alta con menor edad postmenstrual.
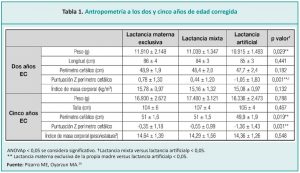
Estos datos coinciden con los resultados del metaanálisis que concluye que los niños alimentados con fórmula experimentan mejor crecimiento a corto plazo que aquellos alimentados con leche de la propia madre, fortificada precozmente de forma universal, por falta de disponibilidad de leche donada en los años analizados en el centro.11
A diferencia de otros artículos,12 se encontró mayor peso a los dos años en los niños alimentados con lactancia materna exclusiva. En RNPT, un metaanálisis reciente apunta que el efecto de la ingesta de fórmula sobre la composición corporal a los 12 meses no es concluyente.13
El estudio de Chinea Jiménez y col., citado,10 añade que la influencia de la ingesta de LM en el crecimiento del perímetro cefálico no sólo se manifiesta hasta los seis meses,14 sino hasta los cinco años en niños alimentados durante las primeras semanas de vida con lactancia materna exclusiva.
Un estudio reciente en RNMBP, muestra que la ingesta de más del 50 % de LM se asocia con mayor volumen cerebral de la sustancia gris central a la edad del tér mino y mejores resultados cognitivos y motores a los siete años.15
Volúmenes cerebrales bajos en la infancia se asocian con resultados adversos a largo plazo.16 El estudio de muestra mejor crecimiento cerebral medido a los dos y a los cinco años por la medición del perímetro ce fálico en relación con el consumo de LM propia en el momento del alta.
Esto podría ser explicado porque la LM contiene nutrientes, como los ácidos grasos poliinsaturados de cadena larga, y posiblemente factores neurotróficos que beneficiarían el cerebro menos desarrollado de los RNPT.8
No existen diferencias significativas en composición corporal, en los tres grupos a los 5 años según la in gesta durante el ingreso.
Por tanto, a los cinco años no se encontró efecto de la alimentación temprana sobre el peso, la talla y la composición corporal. El efecto de la alimentación precoz sobre la composición corporal es diferente en los prematuros que en los recién nacidos a término.17
A los cinco años se evaluó con el test de Kaufman, y se clasificaron los niños globalmente y en la escala verbal y manipulativa según la puntuación que presentaban con respecto a la media para su edad (muy bajo, bajo, medio-bajo, medio, medio-alto, alto y muy alto). La distribución en el nivel global y verbal es diferente según la alimentación durante el ingreso (test de Kruskal-Wallis, p = 0,0162 y p = 0,0083, respectivamente). El nivel de inteligencia global “bajo” aparece en un 24 % en los alimentados con leche artificial, mientras que en los alimentados con leche materna exclusiva no aparecen sujetos con un nivel global “bajo”. Por otro lado, los alimentados con lactancia mixta presen tan un nivel “bajo” en un 5 %. Las comparaciones dos a dos permiten ver que la distribución es diferente en la escala verbal y global en los niños que recibieron exclusivamente LM con aquellos que recibieron fórmula. En el nivel verbal los alimentados con lactancia materna exclusiva al alta presentan un nivel “alto” en el 26 % y los alimentados con lactancia artificial en un 6 % (Figura 1).
Es decir, estos estudios confirman los datos de Lucas y cols., en relación con la mejora de la función cognitiva en los niños alimentados con LM en las primeras semanas de vida.18 En ambos estudios se muestran diferencias en el campo verbal. Así mismo, no se encontraron diferencias a los 24 meses, al igual que Furman y cols.19 Aunque el test de Bayley está validado para evaluar retrasos en el desarrollo temprano, es una herramienta de evaluación global y puede verse limitada para detectar pequeñas diferencias en la función. Por lo tanto, su valor predictivo es dudoso y explica por qué se encuentran diferencias a los cinco años y no a los dos.20

En otro estudio realizado por Chinea Jiménez y col., en el Hospital La Paz (Madrid, España)21 cuyo objetivo fue evaluar el impacto de la introducción de LM donada como complemento de la leche de la propia madre, se encontró que los RNMBP necesitaron un tiempo similar para lograr una tolerancia de la alimentación enteral cuando la LM se suplementó con leche donada fortificada o fórmula para prematuros. No se encontraron diferencias entre los grupos estudiados en la duración de la nutrición parenteral, que fue examinado como sustituto de la tolerancia alimentaria (Figura 2); el 10 % de los bebés en ambos grupos recibieron sólo LM durante la estadía en el hospital; el porcentaje es bajo y similar entre los grupos y no cambia las conclusiones del estudio. Estos resultados son consistentes con los reportados por Vázquez-Román et al.22
Hay varias explicaciones posibles para la falta de mejora en la tolerancia cuando se complementa con leche humana pasteurizada de donantes. Primero, el tratamiento térmico altera los componentes biológicos, por ejemplo, factores de crecimiento, lactoferrina, mioinositol, antioxidantes, lactadherina, mucinas, CD4 soluble y hormonas (leptina).23,24
En segundo lugar, tanto la LM propia como la donada necesitan fortificación.25 El uso de fortificadores derivados de la leche de vaca puede interferir con las ventajas biológicas de la leche humana. Por lo tanto, los productos bovinos pueden influir negativamente en el epitelio intestinal.26
El inicio de la alimentación enteral es anterior si la leche humana está disponible, como es el caso de la disponibilidad de leche donada.
Los RN que se complementaron con leche de fórmula para prematuros tenían al alta mayor peso, longitud y circunferencia de la cabeza y menor caída en la puntuación z de peso, “una definición más racional de restricción del crecimiento postnatal”.27 A pesar de que, en este grupo, un porcentaje menor de lactantes fueron alimentados exclusivamente con fórmula durante el alta, no se encontraron diferencias estadísticas en el peso, longitud y perímetro cefálico.
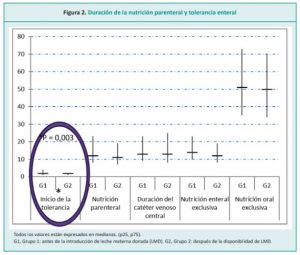
En muchos otros estudios, se observó un crecimiento más lento en los RNMBP alimentados con LM donada versus LM de la propia madre.22 Los resultados del estudio mencionado21 son consistentes con los reportados por Schanler,28 que indicaron que los prematuros con LM de la propia madre que complementaron con LM donada fortificada tuvieron una tasa más lenta de aumento de peso. La LM donada a menudo es proporcionada por madres de RN a término que tienen más de 1 mes de posparto, por lo que es probable que tenga un contenido de proteína más bajo que el ideal para los requerimientos de nutrientes después de la fortificación estándar. El glóbulo lipídico, así como las lipasas y proteasas, pueden alterarse con ciclos de congelación-descongelación. La técnica del Holder puede influir en el crecimiento. La información de composición de la LM no se consideró para el enriquecimiento de la leche humana.
Se encontró una mayor incidencia de displasia bronco pulmonar (DBP) en el grupo que complementó con LM donada. El diseño de este estudio no puede responder si esto se debe a un menor aumento de peso o está relacionado con componentes reducidos o ausentes en LM donada con fortificador que están presentes en la leche de la propia madre y que reducirían la DBP.29.30
La ingesta de leche de la propia madre al alta merece mayor consideración. Durante el período de estudio, la LM donada actuó más como un reemplazo que como un puente hacia la leche de la propia madre. Informes recientes sugieren que la introducción de LM donada no reduce la ingesta de la leche de la propia madre.31,32
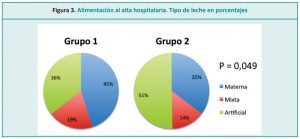
Sin embargo, en este estudio, los resultados son consistentes con los de Esquerra-Zwiers et al.,33 quienes observaron una disminución en la leche de la propia madre recibida por los RN después de la introducción de LM donada (Figura 3). “Los profesionales deben enmarcar el argumento de la superioridad de le leche de la propia madre sobre la leche donada” 24
CONCLUSIONES
La alimentación con LM por parte de los RNPT se asocia con menor tiempo de estancia hospitalaria y menor edad postmenstrual al alta, corregidas por peso al nacimiento y edad gestacional. Los alimentados con fórmula experimentan mejor crecimiento a corto plazo que aquellos alimentados con leche humana fortificada precozmente de forma universal. A los dos y a los 5 años de edad desaparecen las diferencias en el crecimiento observadas durante el primer ingreso. Tampoco aparecen diferencias en la composición corporal a esa edad. Los RNMBP alimentados con LM donada pasteurizada presentan un crecimiento más lento frente a los alimentados con LM de la propia madre. La leche de la propia madre favorece el crecimiento cerebral, medido por el perímetro cefálico, durante el ingreso, a los dos y cinco años. Una intervención temprana como la alimentación exclusiva con leche de la propia madre, tiene una influencia positiva sobre el desarrollo intelectual a los 5 años. Los RNPT necesitan el mismo tiempo para lograr una nutrición enteral total, indistintamente del uso de LM donada fortificada o de leche artificial adaptada a prematuros para complementar la leche de la propia madre.
No disminuye los días de nutrición parenteral ni los días con catéter venoso central con el uso de LM donada pasteurizada para complementar la leche de la propia madre. La ingesta de LM de la propia madre en las UCIN debe ser incentivada particularmente en los RNMBP.
Deberá tenerse en cuenta que la disponibilidad de LM donada podría disminuir la producción la leche de la propia madre. Debemos ser conscientes que la LM donada no tiene las mismas propiedades que la leche de la propia madre por los procesos a los que se somete. Los esfuerzos deben centrarse en promocionar la LM de la propia madre, y en las técnicas a las que se somete la LM.
*Enfermera pediátrica. Doctora en Cuidados en Salud. Servicio de Neonatología. Hospital Universitario La Paz, Madrid, España. Universidad
Complutense de Madrid, España.
**Neonatólogo. Doctor en Medicina. Servicio de Neonatología. Hospital Universitario La Paz, Madrid, España. Universidad Autónoma de
Madrid, España
Correspondencia: bibianachineajimenez@gmail.com
Recibido: 20 de abril de 2020.
Aceptado: 20 de agosto de 2020.
Bibliografía
1. Rogido MR. Nutrición del recién nacido enfermo. Resumen del Tercer Congreso de la Sociedad Iberoamericana de Neonatología (SIBEN). La Habana, Cuba; 2010.
2. Black RE, Victora CG, Walker SP, Bhutta ZA, et al. Maternal and child undernutrition and overweight in lowincome and middle-income countries [published correction appears in Lancet. 2013 Aug 3;382(9890):396]. Lancet. 2013; 382(9890):427-51.
3. Menon G, Williams TC. Human milk for preterm infants: why, what, when and how? Arch Dis Child Fetal and Neonatal Ed. 2013; 98(6): F559-F562.
4. Fustiñana, C. Patrón de crecimiento de niños con bajo peso de nacimiento para asegurar un buen futuro en cuanto a la salud y la nutrición. En: Uauy, R, Carmuega, E, Barker, D. Impacto del crecimiento y desarrollo temprano sobre la salud y bienestar de la población. Perspectivas y reflexiones desde el Cono Sur. 1a ed. Buenos Aires: Instituto Danone del Cono Sur, 2009. p.85-101.
5. Narbona López E. Nutrición enteral y parenteral en recién nacidos prematuros de muy bajo peso. Grupo de Nutrición de la SENeo. Madrid: Ergon; 2013.
6. Morisaki N, Belfort MB, McCormick MC, Mori R, et al. Brief parenteral nutrition accelerates weight gain, head growth even in healthy VLBWs [published correction appears in PLoS One. 2015;10(11):e0143984]. PLoS One. 2014; 9(2):e88392.
7. Aguilar Cordero MJ, Sánchez-López AM, Mur-Villar N, Hermoso-Rodríguez E, Latorre-García J. Efecto de la nutrición sobre el crecimiento y el neurodesarrollo en el recién nacido prematuro: revisión sistemática. Nutr Hosp. 2015; 31(2):716-29.
8. Jain A, Concato J, Leventhal J. How Good Is the Evidence Linking Breastfeeding and Intelligence? Pediatrics. 2002; 109(6):1044-1053.
9. Asociación Española de Pediatría A. Manual de Lactancia Materna. Editorial Médica Panamericana; 2008.
10. Chinea Jiménez B, Awad Parada Y, Villarino Marín A, Sáenz de Pipaón Marcos. Beneficios a corto, medio y largo plazo de la ingesta de leche humana en recién nacidos de muy bajo peso. Nutr Hosp. 2017; 34:1059-66.
11. Quigley M, Embleton NB, McGuire W. Formula versus donor breast milk for feeding preterm or low birth weight infants. Cochrane Database Syst Rev. 2018; 6(6):CD002971.
12. O’Connor DL, Gibbins S, Kiss A, Bando N, et al. Effect of Supplemental Donor Human Milk Compared with Preterm Formula on Neurodevelopment of Very Low-Birth-Weight Infants at 18 Months: A Randomized Clinical Trial. JAMA. 2016; 316(18):1897-1905.
13. Huang P, Zhou J, Yin Y, Jing W, et al. Effects of breast-feeding compared with formula-feeding on preterm infant body composition: a systematic review and meta-analysis. Br J Nutr. 2016; 116(1):132-141.
14. Donma MM, Donma O. The influence of feeding patterns on head circumference among Turkish infants during the first 6 months of life. Brain Dev. 1997; 19(6):393-397.
15. Belfort MB, Anderson PJ, Nowak VA, Lee KJ, et al. Breast Milk Feeding, Brain Development, and Neurocognitive Outcomes: A 7-Year Longitudinal Study in Infants Born at Less Than 30 Weeks’ Gestation. J Pediatr. 2016; 177:133-139.e1.
16.Monson BB, Anderson PJ, Matthews LG, Neil JJ, et al. Examination of the Pattern of Growth of Cerebral Tissue Volumes from Hospital Discharge to Early Childhood in Very Preterm Infants. JAMA Pediatr. 2016; 170(8):772-779.
17.Gale C, Logan KM, Santhakumaran S, Parkinson JRC, et al. Effect of breastfeeding compared with formula feeding on infant body composition: a systematic review and meta-analysis. Am J Clin Nutr. 2012; 95(3):656-669.
18. Lucas A, Morley R, Cole TJ, Lister G, Leeson-Payne C. Breast milk and subsequent intelligence quotient in children born preterm. Lancet. 1992; 339(8788):261-264.
19. Furman L, Wilson-Costello D, Friedman H, Taylor HG, et al. The effect of neonatal maternal milk feeding on the neurodevelopmental outcome of very low birth weight infants. J Dev Behav Pediatr. 2004; 25(4):247-253.
20. Sun H, Como PG, Downey LC, Murphy et al. Infant formula and neurocognitive outcomes: impact of study end-point selection. J Perinatol. 2015; 35(10):867-874.
21. Chinea Jiménez B, Cabrera Lafuente M, Couce ML, Madero R, et al. The influence of donor milk supplementation on duration of parenteral nutrition in preterm infants. J Hum Lact. 2020; 36(2):245-253.
22.Vázquez-Román S, Bustos-Lozano G, López-Maestro M, Rodríguez-López J, et al. Clinical impact of opening a human milk bank in a neonatal unit. An Pediatr (Barc). 2014; 81(3):155-160.
23. ESPGHAN Committee on Nutrition, Arslanoglu S, Corpeleijn W, Moro G, et al. Donor human milk for preterm infants: current evidence and research directions. J Pediatr Gastroenterol Nutr. 2013; 57(4):535-542.
24.Meier P, Patel A, Esquerra-Zwiers A. Donor Human Milk Update: Evidence, Mechanisms, and Priorities for Research and Practice. J Pediatr. 2017; 180:15-21.
25.Radmacher PG, Adamkin DH. Fortification of human milk for preterm infants. Semin Fetal Neonatal Med. 2017; 22(1):30-35.
26.Abdelhamid AE, Chuang SL, Hayes P, Fell JM. Evolution of in vitro cow’s milk protein-specific inflammatory and regulatory cytokine responses in preterm infants with necrotising enterocolitis. J Pediatr Gastroenterol Nutr. 2013; 56(1):5-11.
27. Zozaya C, Díaz C, Saenz de Pipaón M. How Should We Define Postnatal Growth Restriction in Preterm Infants? Neonatology. 2018; 114(2):177-180.
28. Schanler RJ, Lau C, Hurst NM, Smith EO. Randomized trial of donor human milk versus preterm formula as substitutes for mothers’ own milk in the feeding of extremely premature infants. Pediatrics. 2005; 116(2):400-406.29.Assad M, Elliott M, Abraham JH. Decreased cost and improved feeding tolerance in VLBW infants fed an exclusive human milk diet. J Perinatol. 2016; 36(3):216-220.
30. Panczuk JK, Unger S, Francis J, Bando N, et al. Introduction of bovine-based nutrient fortifier and gastrointestinal inflammation in very low birth weight infants as measured by fecal calprotectin. Breastfeed Med. 2016;11(1):2-5.
31. Kantorowska A, Wei JC, Cohen RS, Lawrence RA, et al. Impact of donor milk availability on breast milk useand necrotizing enterocolitis rates. Pediatrics. 2016; 137(3):e20153123.
32.Williams T, Nair H, Simpson J, Embleton N. Use of donor human milk and maternal breastfeeding rates.J Hum Lact. 2016; 32(2):212-220.
33. Esquerra-Zwiers A, Rossman B, Meier P, Engstrom J, et al. “It’s Somebody Else’s Milk”. J Hum Lact. 2015; 32(1):95-102.













