Prof. Lic. Esp. Silvana Nina*
RESUMEN
El hiperinsulinismo congénito (HIC) es uno de los trastornos metabólicos más graves relacionados al metabolismo de la glucosa. Esta patología afecta la secreción de insulina e implica episodios recurrentes de hipoglucemia. Se calcula una incidencia global de 1 cada 30 000-50 000 nacidos vivos. En poblaciones de tradición endogámica llega a ser de 1 cada 2500. Es prioritario confirmar el diagnóstico para establecer un tratamiento precoz con el fin de evitar las secuelas neurológicas. El avance de la terapéutica farmacológica propone en primera instancia el uso de diazóxido, aunque la pancreatectomía es todavía el tratamiento más eficaz en los casos graves.
Palabras clave: hiperinsulinismo congénito, hipoglucemia, diazóxido.
Cómo citar:
Nina SN. Diazóxido e hiperinsulinismo neonatal. Rev Enferm Neonatal. Enero 2017;22:14-17.
Desarrollo:
El HIC es la causa más común de hipoglucemia persistente, es decir valores menores a 40 mg/dl, en la etapa neonatal y en la infancia con un alto riesgo de provocar convulsiones, daño cerebral permanente y retraso en el desarrollo. Frecuentemente sucede en la etapa neonatal, pues cerca del 60% de los pacientes presentan síntomas antes de las 72 h de vida.1 Se caracteriza por la deficiente regulación de la secreción de insulina en las células del páncreas que moviliza la glucosa hacia los tejidos sensibles a la insulina, especialmente al músculo esquelético, tejido adiposo e hígado provocando hipoglucemia grave.2 En condiciones normales, cuando los niveles de glucosa disminuyen por debajo de 60 mg/dl, las células β pancreáticas producen pequeñas cantidades de insulina. En lactantes con esta patología la insulina permanece elevada aun con niveles de glucosa muy disminuidos.3
La base genética del HIC involucra defectos en genes claves que regulan la secreción de insulina en las células del páncreas. Las mutaciones en ocho genes diferentes (ABCC8, KCNJ11, GLUD1, CGK, HADH, SLC16A1, HNF4A y UCP2) se han identificado hasta la fecha en pacientes con formas congénitas de hiperinsulinismo. Las formas más graves se deben a mutaciones en los genes ABCC8 y KCJN11, que codifican los dos componentes de los canales de potasio sensibles al ATP de las células β del páncreas.4 Desde el punto de vista histológico puede presentarse en formas difusa, focal y atípica. La forma difusa del HIC es heredada de modo autosómico recesivo o de manera dominante; y la forma focal es una herencia esporádica. La forma difusa de la enfermedad puede requerir una pancreatectomía casi total con alto riesgo (95%) de desarrollar diabetes mellitus, mientras que la forma focal requiere pancreatectomía “limitada” permitiendo la cura del paciente.2
La HIC se diagnostica con mayor frecuencia en el período neonatal con signos clínicos graves: apneas y convulsiones. Pero también puede manifestarse con signos menos graves e inespecíficos como rechazo al alimento, irritabilidad, letargo, inestabilidad para termorregular, hipotonía, palidez y apnea.2,4 Los recién nacidos con HIC pueden ser macrosómicos debido a la hiperinsulinemia en la vida fetal, en particular los que llevan mutaciones en el gen HNF4A. Algunos pacientes presentan miocar-diopatía hipertrófica y hepatomegalia lo que probablemente refleja la hiperinsulinemia fetal. Puede estar asociada con otros síndromes, siendo el más común el síndrome de Beckwith-Wiedemann.4
Dada la clínica del RN deben diferenciarse otras patologías que pueden provocar hipoglucemias transitorias: prematurez, hijo de madre con diabetes gestacional insulinodependiente, retardo de crecimiento intrauterino (RCIU), asfixia perinatal u otras como sepsis, hipopituitarismo, alteración hipofisaria, alteración en la secreción de hormonas contrarreguladoras, tras-tornos congénitos del metabolismo, alteración en la secreción pancreática de insulina, defectos del metabolismo de aminoácidos y ácidos grasos que pueden provocar hipoglucemias de mayor gravedad y que no se corrigen fácilmente.
El tratamiento de pacientes con HIC puede ser extremadamente complicado. Se recomienda derivar a estos pacientes a centros especializados que habitualmente cuentan con un equipo multidisciplinario, laboratorio para el procesamiento de muestras y estudios por imágenes necesarios para determinar el diagnóstico.
El principal objetivo es mantener la glucemia en valores mayor a 70 mg/dl, ya sea por medio de la terapia farmacológica o por el tratamiento quirúrgico. Estos pacientes no tienen la capacidad de generar sustratos alternativos para que utilice el cerebro durante los episodios de hipoglucemia.1 Es fundamental administrar glucosa por vía intravenosa, junto con alimentación enteral a través de una sonda orogástrica, para asegurar el aporte de carbohidratos. Pueden presentar varias complicaciones como sobrehidratación, insuficiencia cardíaca y sepsis. Requieren de monitoreo de glucemia frecuente, cada 30-60 minutos, y la inserción de un catéter venoso central para la infusión de dextrosa en altas concentraciones para disminuir los riesgos de extravasación en los accesos venosos periféricos.
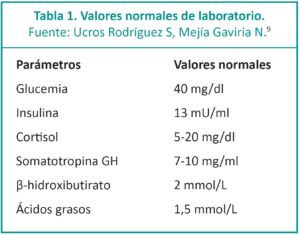
Para confirmar o descartar el diagnóstico de HIC de-ben realizarse determinados estudios en sangre como concentración de insulina, glucagón, hormona de crecimiento, cortisol, β-hidroxibutirato y ácidos grasos libres. Estas muestras deben ser tomadas cuando el neonato se encuentra en hipoglucemia.
El diagnóstico puede determinarse basándose en la gravedad de la hipoglucemia que ocurre dentro de las primeras 72 horas de vida. Entre los criterios bioquímicos que caracterizan esta entidad se encuentran: hipoglucemia sin cetosis, el cociente glucemia/insulina <3 (valor normal >5), el cortisol alto y la hormona de crecimiento (GH) normal/alta, el β-hidroxibutirato, los triglicéridos y los ácidos grasos libres en plasma disminuidos (lipólisis inhibida).5
El estudio genético de los padres resulta orientativo ante el fracaso al tratamiento inicial con diazóxido. Existen métodos por imágenes no invasivos y muy precisos que ayudan a definir si el HIC es focal o difuso; el PET SCAN (tomografía por emisión de positrones) definirá qué tipo de tratamiento seguir pues describe la función del organismo en tiempo real.6