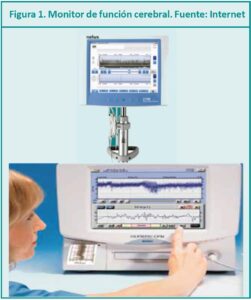
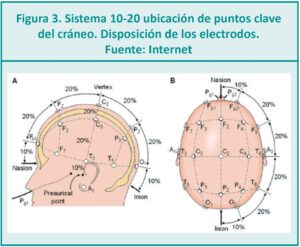
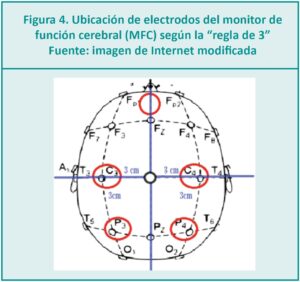
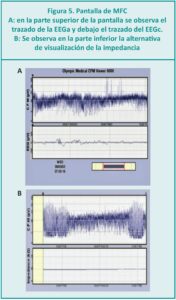
¿Qué datos nos ofrece la EEGa?
La EEGa se basa en el análisis del trazado, mediante la evaluación del ¨patrón de fondo¨ o ¨trazado base¨ que se visualiza en la parte superior del monitor (Figura 5-a) y grafica las variaciones de la amplitud y el ancho del mismo. La amplitud es medida entre los márgenes superior e inferior de la EEGa del trazado mínimo y máximo que se miden en la escala logarítmica (0-10 µV) o semilogarítmica (10 – 100 µV) donde aparece el registro del trazado. El ancho es la diferencia entre estos dos márgenes. Su valor normal debe estar entre >5 µV para el inferior y >10 µV el superior.
Una alternativa del monitor es observar en la pantalla el EEGc debajo del MFC como se visualiza en la Figura 5-a. En la Figura 5-b se puede observar en la parte inferior de la pantalla del monitor en forma alternativa, la impedancia: su valor tiene que ser de 0 (cero). De esta manera nos informa sobre la calidad de la señal y que la correlación entre el ECGc y la ECGa es correcta.
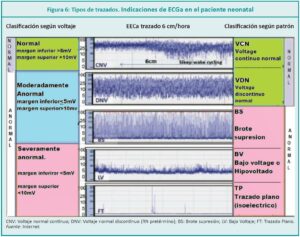
Con el tiempo se desarrollaron distintas escalas para clasificar e interpretar los trazados de la EEGa. En 1999, Al Naqueeb describe una escala basándose en las variaciones de voltaje en la actividad eléctrica, donde distingue tres patrones:1
1. Normal: margen inferior >5 µV y margen superior> 10 µV.
2. Moderadamente anormal: margen inferior < 5 µV. Y margen superior > 10 µV.
3. Suprimido: con márgenes inferiores < 5mV y margen superior < 10 mV.
La desventaja de esta clasificación es que podría tomarse los patrones normales de los RN prematuros como moderadamente anormales, ya que los cambios madurativos de la actividad cerebral son reflejados en la EEGa.
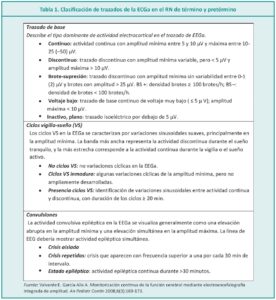
En el año 2006, Hellstron-Westas realizaron una clasificación basada en la nomenclatura de la EEGc (Tabla 1) fácil de utilizar. En ella se destacan cuatro variables: patrón de fondo o trazado de base, número de brotes, ciclos vigilia-sueño (VS) y crisis epiléptica.1
Gran porcentaje de los RN que ingresan a la Unidad de Cuidado Intensivo Neonatal (UCIN) tienen un alto riesgo de desarrollar complicaciones cerebrales. La exploración o evaluación a nivel neurológico es limitada en algunas situaciones clínicas, por el tratamiento proporcionado al paciente (ventilación mecánica, sedación y relajación muscular, entre otros).
Las indicaciones de MFC o EEGa son los recién nacidos asfícticos con encefalopatía hipóxico-isquémica, los recién nacidos que hayan presentado convulsiones y los recién nacidos prematuros.
• RN con encefalopatía hipóxico-isquémica (EHI): la EEGa es una herramienta predictiva precoz del pronóstico neurológico, proporciona información sobre la gravedad de la encefalopatía en las primeras 6 a 12 h del evento hipóxico del RN. Se ha utilizado, en algunos ensayos, como criterio de selección para evaluar la efectividad del tratamiento con hipotermia. La presencia de una EEGa normal no contraindica el inicio del tratamiento de hipotermia.
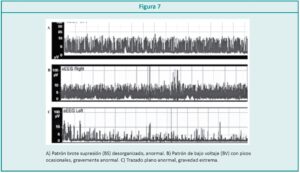
Algunos estudios muestran que los RN con trazados continuos o discontinuos de voltaje normal, tiene una evolución neurológica favorable en comparación con los RN que presentaron trazados anómalos como brote supresión (BS), bajo voltaje (BV) o trazado plano o inactivo (FT) (Figura 7). Los RN que recuperan o mejoran su trazado en las primeras 24 a 36 h tienen mejor pronóstico neurológico; esta mejoría se observa con la normalización del trazado y la aparición de ciclos vigilia-sueño.
• Convulsiones: la EEGa facilita el diagnóstico temprano de las convulsiones subclínicas. En el RN pueden ser frecuentes y sutiles. Según estudios con videoelectroencefalografía, solo 20% de las convulsiones son detectadas clínicamente. Además, con la administración del primer fármaco anticonvulsivo se produce disociación electroclínica, los signos clínicos desaparecen, pero la actividad eléctrica persiste. La EEGa puede detectar hasta 80% de las convulsiones.5 El monitoreo prolongado permite detectar la presencia de crisis epilépticas convulsivas, determinar su duración y distribución espacial. La EEGa ayuda a diferenciar entre el origen epiléptico o no de fenómenos motores paroxísticos frecuentes en el RN.
Es importante tener en cuenta, que la información que provee la EEGa es el registro de uno o dos canales, comprimidos en tiempo, por lo que algunas crisis focales, de bajo voltaje y/o corta duración pueden pasar inadvertidas. Las interferencias por la actividad muscular o por artefactos como los equipos electrónicos podrían producir elevación en el margen superior e inferior, confundiéndolas con actividad epiléptica. Ante la presencia de un registro anómalo es indicación realizar un electroencefalograma convencional.
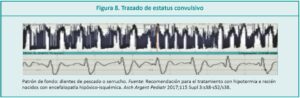
La actividad convulsiva se observa, con un trazado superior elevado y estrecho, verificando siempre que el trazado de la impedancia se encuentre en cero para que esta sea adecuada y el EEGc muestre ondas anormales. Cuando este patrón se vuelve repetitivo estamos en presencia de un estatus convulsivo, reflejado en el patrón de fondo como “dientes de pescado” o “serrucho” (Figura 8).
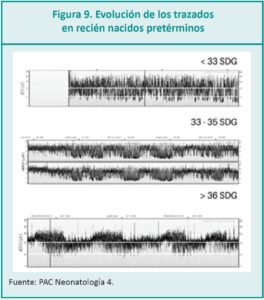
• RN prematuro: La ontogenia de la actividad eléc-trica del RN depende de la edad gestacional (EG). Es necesario saber la EG del RN para no interpretar incorrectamente un trazado. Los estudios coinciden, que el trazado de base del RN prematuro es discontinuo, caracterizado por periodos de brotes de alto voltaje con periodos de baja amplitud, con brotes de actividad eléctrica y periodos sosegados más breves.4 El trazado de la EEGa va ¨madurando¨ conforme a la EG, donde a mayor EG aumenta la continuidad del trazado y disminuyen los intervalos de brotes de actividad. Los ciclos de sueño-vigilia se reconocen en el EEG desde las 30 semanas de gestación. Es muy importante que los profesionales a cargo de interpretar la EEGa conozcan la EG del RN. La interpretación de los trazados en el periodo neonatal exige el conocimiento de la evolución normal del EEG en los estadios prematuros hasta alcanzar la edad corregida en el periodo posnatal; disminuyen los intervalos de brotes de mayor acti-vidad y mayor amplitud, y aumentan los períodos más silentes entre cada brote.
Se puede observar, además, las anomalías en el trazado de base cortical comunes en los RN prematuros con hemorragia en la matriz germinal e intraventricular. Los cambios en fase aguda, cuando se está produciendo la hemorragia son inespecíficos; se caracterizan por una depresión de la amplitud en el trazado de base, con aumento de la discontinuidad y presencia de actividad epiléptica en un 75% de los pacientes.4 El grado de depresión de la actividad está relacionado con la gravedad de la hemorragia.