Dra. María Cecilia Rubio Longo*, Farm. Mónica Travaglianti**
Tratamiento farmacológico del dolor del recién nacido
RESUMEN
Los niños hospitalizados están expuestos a múltiples procedimientos dolorosos. Cada centro de atención debe implementar un programa integral de prevención y manejo del dolor en el neonato que incluya utilizar estrategias para su evaluación rutinaria, minimizar el número de procedimientos dolorosos, reducir la exposición a estímulos ambientales como luz y ruidos, y emplear protocolos que incorporen el uso de medidas no farmacológicas y farmacológicas de manera efectiva. Con respecto a la administración de fármacos, resulta fundamental seleccionar cuidadosamente a aquellos que presenten mayor evidencia de eficacia y seguridad.
Los neonatos constituyen la población con menor información respecto de las dosis, el comportamiento farmacocinético y farmacodinámico de los medicamentos debido a que existen escasos estudios clínicos robustos en pacientes de este rango etario.
Sin embargo, conocer las características de los medicamentos actualmente disponibles para el manejo de la sedo-analgesia en la población neonatal constituye un objetivo fundamental para el uso adecuado, seguro y eficiente de estos fármacos.
En este artículo se desarrollan los usados con mayor frecuencia en esta población.
Palabras clave: dolor, neonato, tratamiento farmacológico, analgésicos.
ABSTRACT
Hospitalized children are exposed to multiple painful procedures. Each care center should implement a comprehensive program for the prevention and management of pain in the newborn that includes using strategies for routine evaluation, minimizing the number of painful procedures, reducing exposure to environmental stimuli such as light and noise, and using protocols that incorporate the use of non-pharmacological and pharmacological measures effectively. With regard to the administration of drugs, it is essential to carefully select those who present greater evidence of efficacy and safety.
Neonates constitute the population with the least information regarding the dose, pharmacokinetic and pharmacodynamic behavior of medications because there are few robust clinical studies in patients of this age range.
However, knowing the characteristics of the medications currently available for the management of sedo-analgesia in the neonatal population is a fundamental objective for the proper, safe and efficient use of these drugs.
This article develops the most frequently used in this population.
Keywords: pain, neonate, pharmacological treatment, analgesics.
Cómo citar:
Rubio Longo MC, Travagliani M. Tratamiento farmacológico del dolor del recién nacido. Rev Enferm Neonatal. Abril 2020;32:27-39.
INTRODUCCIÓN
Los neonatos prematuros y nacidos a término son capaces de percibir dolor. Los niños hospitalizados en unidades de cuidado intensivo, están expuestos a múltiples procedimientos dolorosos tales como extracciones de sangre, colocación de accesos venosos vasculares, colocación de sonda nasogástrica y aspiración de secreciones, además de otros procedimientos de rutina como las evaluaciones médicas, de enfermería y kinesiología, y estímulos ambientales como luces y ruidos. 1,2
El dolor produce estrés y ambas condiciones pueden afectar negativamente la evolución de los niños críticamente enfermos y aumentar su morbilidad y mortalidad.1,3
A pesar de que existe una mayor conciencia de esta realidad por parte del equipo de salud, las estrategias para lograr un adecuado manejo del dolor en estos pacientes suelen ser ineficaces y, desafortunadamente, continúa siendo poco reconocido e insuficientemente tratado.1
La prevención y manejo del dolor debe ser una premisa en la atención de cada paciente. Cada centro debe implementar un programa que incluya estrategias para la evaluación rutinaria del dolor mediante escalas validadas diseñadas para este fin, minimizar el número de procedimientos dolorosos, los episodios de manipulación del paciente y los estímulos ambientales como la luz y los ruidos, y utilizar protocolos que incluyan el uso de medidas no farmacológicas y farmacológicas antes de cualquier manipulación o procedimiento.4
Por lo tanto, y para garantizar que el dolor sea controlado adecuadamente, antes de realizar un procedimiento se debe pautar qué escala y estrategia de dolor va a ser utilizada, y qué circunstancias pueden requerir aportes adicionales o ajustes terapéuticos.5
La estrategia analgésica debe incluir una combinación de medidas no farmacológicas y farmacológicas presentadas de forma gradual, con una estrategia de analgesia creciente, a medida que aumenta el grado de dolor que se espera para ese procedimiento, con un enfoque similar a la escalera analgésica de la OMS para el tratamiento del dolor en adultos.4 Se plantea el tratamiento como una serie de pasos o escalones con opciones de analgesia creciente:
• Paso 1: medidas no farmacológicas (amamantamiento, uso del chupete, contención, arropamiento, contacto piel a piel) y administración de sucrosa.
• Paso 2: anestésicos tópicos (EMLA® lidocaína-prilocaína).
• Paso 3: acetaminofeno/paracetamol.
• Paso 4: opioides (morfina- fentanilo).
• Paso 5: Infiltración subcutánea de lidocaína o bloqueo nervioso específico.
• Paso 6: sedoanalgesia profunda (combinación de opioides, sedantes y otras drogas) o anestesia general.
Los fármacos deben ser utilizados para el manejo del dolor moderado o grave. Los más empleados son la sucrosa (sacarosa), los opiáceos, el acetaminofeno (paracetamol) y, en menor medida, los anestésicos locales. En cada caso, deben administrarse asociados a medidas no farmacológicas para optimizar su acción.6
Para garantizar un empleo seguro, es necesario conocer los efectos de los distintosfármacos analgésicos en los neonatos y sus características según la edad gestacional del niño.5 Cada vez que se utiliza un tratamiento farmacológico, se debe considerar el balance de los beneficios vs. los efectos adversos de la intervención.4
Debe evitarse el uso de fármacos con poca evidencia de seguridad en el neonato dado que podrían tener impacto deletéreo a largo plazo. El midazolam ha sido asociado a tasas más altas de hemorragia intraventricular, leucomalacia periventricular o muerte, comparado con los que recibieron placebo,6,7 por lo que no debería ser utilizado en neonatología.6
Es importante recordar que las benzodiazepinas, el hidrato de cloral y los paralizantes musculares no poseen efecto analgésico.
Se describen a continuación los fármacos más frecuentemente empleados.
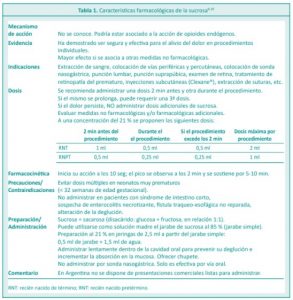
SUCROSA (SACAROSA)
Es útil en la reducción del dolor leve a moderado en procedimientos puntuales tanto en niños de término como en prematuros. Para la Academia Americana de Pediatría8 el uso de esta solución es considerado dentro de las intervenciones farmacológicas, no así para otras sociedades científicas pediátricas. La administración de sucrosa requiere prescripción y seguimiento.6 Un metanálisis de 74 estudios que incluyeron 7049 lactantes con edad gestacional de hasta 44 semanas concluyeron que la sucrosa ha mostrado ser segura y efectiva para el alivio del dolor en procedimientos individuales.9
Su mecanismo de acción no está bien definido; podría estar asociado a la acción de opioides endógenos (beta-endorfinas). También se sugieren mecanismos adicionales vinculados con las vías dopaminérgicas y colinérgicas; sin embargo, el mecanismo de acción no se conoce exactamente en el recién nacido humano.8,10
Se ha observado un efecto analgésico aditivo cuando la sucrosa se usa junto con otras medidas no farmacológicas, como la succión no nutritiva y el arropamiento o envoltura.
Se utiliza para reducir el dolor agudo, episódico, por procedimientos que incluyen: punción de talón, venopuntura, colocación de un acceso venoso periférico, sondaje vesical y examen de la retina en prematuros. Debe combinarse con otros agentes analgésicos para procedimientos como punción lumbar, circuncisión y colocación de un catéter percutáneo.4
La sucrosa inicia su efecto a los 10 segundos, el efecto pico se observa a los 2 minutos y el efecto analgésico se sostiene durante 5-10 minutos.10 Por ello, se recomienda administrar una primer dosis 2 minutos antes del inicio del procedimiento y repetirla a los 2 minutos si el mismo se prolonga.
Debe ser administrada lentamente dentro de la cavidad oral para prevenir su deglución e incrementar la absorción en la mucosa, con una jeringa o mediante el uso de un chupete.10 No se debe administrar por sonda gástrica, ya que solo es efectiva por vía oral.
Se necesitan más estudios para determinar los efectos adversos de la sucrosa a largo plazo, fundamentalmente en prematuros11 Por lo tanto, sólo se debe utilizar para intervenciones puntuales y evitar el uso abusivo como para calmar cualquier situación de llanto no relacionada con dolor.
En la Tabla 1 se resumen las características farmacológicas de la sucrosa.
ACETAMINOFENO (PARACETAMOL)
El acetaminofeno o paracetamol es un analgésico con acción antipirética. No se conoce el mecanismo exacto. Actúa a nivel central y en menor medida a nivel periférico. La acción antipirética está relacionada a la inhibición de la síntesis de prostaglandinas a nivel hipotalámico.10
Debe ser utilizado en casos de dolor leve a moderado, ya que es un fármaco poco potente y la analgesia no aumenta con el incremento de la dosis, es decir posee efecto techo.5
No debe ser usado en forma aislada para el manejo del dolor grave posoperatorio, pero puede ser considerado durante el período posoperatorio tardío, luego de procedimientos menores o en forma conjunta a otras medidas. Su efecto analgésico puede ser aditivo, cuando se utiliza combinado con opioides para el tratamiento del dolor agudo grave asociado a procedimientos o al período posoperatorio inmediato; su administración conjunta puede favorecer una disminución de la cantidad total de opioides y de los efectos adversos asociados a los mismos. Ha mostrado limitada eficacia para reducir el dolor en procedimientos como la circuncisión, exámenes oftalmológicos o punción de talón.12
Puede administrarse por vía oral, rectal o endovenosa. En recién nacidos de término y prematuros el clearance del fármaco es más lento que en niños mayores por lo que las dosis requeridasson menosfrecuentes.4
Los efectos adversos reportados son dosis dependientes. A diferencia de niños mayores y adultos, la toxicidad hepática por acetaminofeno en el recién nacido es rara. Ha sido reportada por administración de dosis repetidas en administración crónica, por error en la prescripción y administración debido a las diferencias entre la presentación oral y endovenosa de paracetamol y por pasaje transplacentario debido a la ingesta de sobredosis materna.13-16
Su metabolismo es hepático y su excreción por orina. Las vías metabólicas principales son la conjugación para formar sulfato o glucuronato de acetaminofeno. En el recién nacido la vía de eliminación principal es la sulfatación y no la glucuronización por lo que está más protegido con respecto a una potencial toxicidad, sumado a la menor actividad de la enzima citocromo P450 que limita la producción de metabolitos tóxicos.5
En la Tabla 2 se resumen las características farmacológicas del paracetamol.
ANTI-INFLAMATORIOS NO ESTEROIDEOS
Los anti-inflamatorios no esteroideos (AINE) actúan inhibiendo la enzima ciclooxigenasa (COX) bloqueando la síntesis de prostaglandinas.
Los AINE son usados extensamente en niños mayores y adultos, y en forma escasa en el período neonatal por sus efectos adversos.
En estudios que evaluaron el uso de indometacina e ibuprofeno para el tratamiento del ductus arterioso persistente en el prematuro, su utilización estuvo asociada con sangrado gastrointestinal, disfunción plaquetaria y disminución del filtrado glomerular.4
Los AINE no deben ser utilizados para analgesia en el período neonatal dado que existen agentes disponibles más seguros y eficaces.
ANALGÉSICOS OPIÁCEOS
Los opioides son considerados los fármacos con mayor efecto analgésico y sedante para el control del dolor moderado a grave en pacientes de todas las edades.4
Constituyen la principal herramienta farmacológica para la analgesia en el neonato.5,8
Imitan la acción de las endorfinas al inhibir la actividad de la adenilcilcasa. Esto se manifiesta por una hiperpolarización neuronal con supresión de la descarga espontánea y respuestas evocadas. También interfieren en el transporte transmembrana de iones calcio y actúan en la membrana presináptica donde interfieren con la liberación del neurotransmisor.10 De este modo, interactúan con receptores específicos en el sistema nervioso central y periférico para modificar la transmisión de las señales dolorosas y disminuir la percepción del dolor.5
En dosis equivalentes, producen analgesia potente, poseen efectos fisiológicos similares1,17 y atenúan las respuestas fisiológicas al estrés.4
No poseen efecto techo, es decir, que al titular la dosis del paciente, ésta puede escalarsegún el requerimiento del niño, hasta lograr su confort.
Los más utilizados y estudiados en el periodo neonatal son la morfina y el fentanilo.5
Ambos son equivalentes a dosis equipotentes; el fentanilo es 50-100 veces más potente que la morfina,10 lo que no significa que sea más analgésico que ella, sino que se requiere menor dosis para lograr el mismo efecto.1
Su administración prolongada se asocia a tolerancia y dependencia. La tolerancia se refiere a la necesidad de aumentar la dosis para sostener el mismo efecto farmacológico cuando se emplean por tiempo prolongado. La dependencia significa que, con la disminución brusca o suspensión de esta medicación, el paciente puede desarrollar síndrome de abstinencia.1
Otra característica es su reversibilidad. La naloxona es un antagonista competitivo de todos los receptores opioides; actúa por desplazamiento del fármaco de los receptores opiáceos, por lo que se revierten todos sus efectos, incluso el efecto analgésico.1
Otros efectos generales de los opioides incluyen depresión respiratoria, apnea, vasodilatación arterial y venosa (asociada a liberación de histamina por efecto de la morfina), disminución de la peristalsis intestinal, nauseas, vómitos y retención urinaria.5

La respuesta farmacológica a los opioides presenta una gran variabilidad intra- e interindividual en el recién nacido. Dicha variabilidad es producto de la inmadurez de los sistemas CYP y de conjugación hepática, del filtrado glomerular y de los polimorfismos en los genes implicados en el control del dolor.18-20
Por todas estas características, la administración de opioides requiere vigilancia estrecha. Deben ser utilizados en un ambiente controlado, con capacidad para el monitoreo continuo de los signos vitales y administrado por personas con experiencia en el manejo de la vía aérea.5
En la Tabla 3 se resumen las características farmacológicas de los opiáceos.
• Morfina
La morfina es el opioide más utilizado para el control del dolor en el neonato.4 Tiene efectos analgésicos y sedantes más duraderos que el fentanilo, inicio de acción más lento y menor potencial de inducir tolerancia que el fentanilo.10 Con respecto a sus efectos secundarios, el efecto hipotensor de la morfina (asociado a liberación de histamina) es más probable en los prematuros de 23-26 semanas de edad gestacional o en neonatos con inestabilidad hemodinámica previa, pero puede ocurrir en todos los niños cuando se utilizan dosis altas (100-200mcg/kg).5 También se ha descripto que su uso podría demorar el tiempo para lograr el aporte enteral total en prematuros.1,21
El uso rutinario de morfina en recién nacidos ventilados no está recomendado. Bellu y colaboradores,22 realizaron una revisión sistemática y meta-análisis donde no hallaron evidencia suficiente para recomendar el uso rutinario de opioides en neonatos con ventilación mecánica y sugieren que sean usados selectivamente basados en el juicio clínico y la evaluación individual.
Está indicado para el manejo del dolor moderado a grave asociado a cirugías, procedimientos invasivos y enfermedad grave.4 También para el tratamiento del síndrome de abstinencia.
• Fentanilo
El fentanilo es un opioide sintético frecuentemente usado en neonatos por su capacidad para proveer rápida analgesia, mantener la estabilidad hemodinámica, bloquear las respuestas endócrinas al estrés y prevenir el aumento de las resistencias pulmonares inducidas por dolor.1
La analgesia y la sedación producidas por este fármaco tienen un comienzo de acción más rápido y duración de acción más corta respecto de la morfina.
Se reconoce al fentanilo como un opioide de acción corta, aun cuando posee una prolongada vida media de eliminación. Presenta un comienzo de acción casi inmediato (≈30 seg) tras la administración intravenosa.10 El efecto máximo se observa a los 3-5 minutos (es 4-8 veces más rápido que la morfina), pero su acción luego de una dosis en bolo se extiende por alrededor de 60 minutos debido a la rápida redistribución y acumulación en tejidos grasos y musculares del cuerpo.
Se ha reportado rigidez de tórax asociada o no con laringoespasmo cuando se infunde rápidamente una dosis mayor de 2 mcg/kg,1,3 por lo que la administración debe ser lenta, durante 3-5 minutos. Este es un efecto adverso grave que requiere relajación muscular o administración de naloxona para revertirlo.1,3,5
Sus características lo hacen una alternativa especialmente útil para administrar analgesia en casos de hipertensión pulmonar (hipertensión pulmonar primaria y secundaria a aspiración de líquido amniótico meconial, hernia diafragmática) o de labilidad hemodinámica (cirugía cardiovascular, shock). Otra ventaja clínica es su rápido inicio de acción, por lo que es preferible a la morfina para el control del dolor en procedimientos como la intubación endotraqueal.5
La tolerancia al fentanilo se desarrolla másrápidamente que con la morfina y requiere un aumento escalonado de la dosis durante su administración prolongada.1,3,23 La suspensión brusca del tratamiento durante más de 5 días puede desencadenar síndrome de abstinencia.10
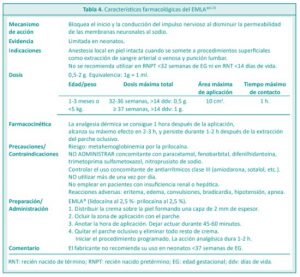
ANESTÉSICOS LOCALES
Pueden proporcionar alivio del dolor durante algunos procedimientos.8
Tanto la lidocaína como la prilocaína estabilizan las membranas neuronales mediante la inhibición de los flujos iónicos necesarios para la iniciación y conducción de los impulsos nerviosos, y efectúan de este modo la acción anestésica local.10
• Lidocaína-prilocaína (EMLA®)
Provee anestesia local sobre la piel intacta cuando se somete a procedimientos superficiales donde se utilicen agujas. Se usa con parche oclusivo.10
El inicio, profundidad y duración de la analgesia dérmica en la piel intacta proporcionada por la crema de lidocaína y prilocaína dependen principalmente de la duración de la aplicación. La analgesia dérmica se consigue 1 hora después de la aplicación, alcanza máximo efecto en 2 a 3 horas, y persiste durante 1 a 2 horas después de la extracción del parche oclusivo.10
Ha demostrado disminuir las puntuaciones de dolor al ser utilizada durante la punción venosa y la punción lumbar, especialmente si el paciente recibe en forma simultánea solución oral de sucrosa.4,8,24 No ha mostrado beneficios en la punción del talón.8
Los efectos adversos están relacionados con la prilocaína e incluyen irritación local de la piel y metahemoglobinemia. Poseen mayor riesgo con la aplicación excesiva, tiempo de contacto prolongado,25 uso concomitante de fármacos inductores de metahemoglobinemia (fenitoína, fenobarbital, nitroglicerina, nitroprusiato de sodio, paracetamol) y en menores de 37 semanas.10
La evidencia actual sobre la utilización de anestésicos locales en recién nacidos, requiere más estudios de eficacia y seguridad, así como también de la aplicación repetida, especialmente en recién nacidos pretérmino. No se ha realizado ninguna evaluación de los efectos a largo plazo de los anestésicos tópicos en los recién nacidos.24
En la Tabla 4 se resumen las características farmacológicas del EMLA®
• Lidocaína
Se utiliza como anestésico local o regional por infiltración local o bloqueo del nervio periférico.
La lidocaína al 1 % se inyecta localmente para reducir el dolor asociado con la colocación de un catéter venoso percutáneo o un catéter arterial, circuncisión,2 colocación de tubos de drenaje pleural y en sitios de acceso de cirugía mínimamente invasiva, para reducir el dolor posoperatorio.
Debido a su menor capacidad enzimática, muy raramente los recién nacidos tienen riesgo de metahemoglobinemia.10
La lidocaína se presenta en diferentes concentraciones y formulaciones farmacéuticas. Es necesario prestar mucha atención a la formulación utilizada a fin de evitar un error y posibles efectos adversos graves.
En la Tabla 5 se resumen las características farmacológicas de la lidocaína.
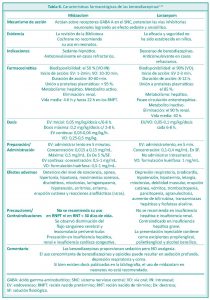
BENZODIAZEPINAS
Son utilizadas en forma amplia y empírica en las Unidades de Cuidado Intensivo Neonatal.1
Actúan sobre receptores específicos en el sistema nervioso central, potencian la acción inhibitoria del neurotransmisor ácido gamma-aminobutírico (GABA) sobre sus receptores ionotrópicos (GABA A), lo que permite una mayor entrada del ión cloro a las neuronas y favorece la hiperpolarización de su potencial de membrana. El estado resultante de inhibición neuronal explica los efectos farmacológicos sedante-hipnótico, ansiolítico y anticonvulsivante. No poseen acción analgésica.10
Se han reportado efectos neurológicos adversos asociados con la administración de midazolam en recién nacidos de término y prematuros que incluyen deterioro del nivel de conciencia, falta de seguimiento visual, hipertonía, hipotonía, movimientos coreicos, discinéticos, mioclonías y actividad epileptiforme. En todos estos casos, los efectos fueron transitorios, aunque no se informaron resultados del desarrollo neurológico a largo plazo.1 Dos estudios (Van Straaten 1992,26 Harte 199727) encontraron una disminución significativa en la velocidad del flujo en la arteria cerebral media en prematuros que recibieron una única dosis en bolo de midazolam. Este efecto duró hasta una hora y se relacionó con una disminución en la presión arterial media. Por ello, los efectos neurológicos del midazolam podrían estar relacionados con una hipoperfusión cerebral transitoria.1.7
Datos en modelos animales recién nacidos sugieren que el midazolam podría inducir apoptosis y/o necrosis de neuronas y otras células del cerebro en desarrollo de forma independiente del receptor de benzodiacepinas.4
Ng E. y colaboradores,7 realizaron una revisión sistemática y meta-análisis respecto de la infusión de midazolam para la sedación de neonatos en la Unidad de Cuidados Intensivos Neonatales. Se incluyeron 3 estudios (Jacqz-Aigrain 1994, Anand 1999, Arya 2001) sobre 146 niños. Se emplearon diferentes escalas para evaluar la sedación. Se observó un mayor nivel de sedación en el grupo que recibió midazolam respecto del grupo placebo. Ninguna de las escalas que se utilizó estaba validada para prematuros, por lo cual la eficacia del uso de midazolam en esta población no pudo ser comprobada. El estudio de Anand publicado en 1999, mostró una mayor incidencia de pronóstico neurológico adverso (muerte, hemorragia intraventricular grado III o IV o leucomalacia periventricular) en el grupo midazolam en comparación con los otros grupos. Por lo tanto, no existe suficiente evidencia para promover el uso de midazolam como sedante para neonatos en la Unidad de Cuidados Intensivos Neonatales y existe preocupación respecto de la seguridad de su uso, sobretodo en relación con la neurotoxicidad.8
En la Tabla 6 se resumen las características farmacológicas de las benzodiazepinas.

CONCLUSIONES
Los recién nacidos de término y prematuros percibenel dolor.
La prevención, valoración y manejo del dolor en recién nacidos debe ser la meta de todoslos profesionales de la salud. Cada unidad debe contar con un programa integral que incluya su evaluación rutinaria, la reducción de la exposición a estímulos ambientales, la manipulación del paciente y el número de procedimientos dolorosos, el empleo de estrategias que incluyan medidas no farmacológicas y farmacológicas de manera efectiva.1,4
Desde el punto de vista de la seguridad para el paciente, la realización de estudios clínicos robustos dentro de este grupo etáreo son complejos debido a la presencia de distintos subgrupos dentro de esta población.
La inmadurez de los órganos impacta en el comportamiento de los fármacos desde la absorción hasta la eliminación de sus metabolitos. Las dosis utilizadas de estos y otrosfármacos, con frecuencia son el resultado de extrapolaciones de pacientes pediátricos e incluso adultos. Los efectos clínicos muchas veces no resultan los esperados y otras veces los resultados pueden ser fatales. Los estudios farmacocinéticos y farmacodinámicos, los reportes de farmacovigilancia y los estudios a largo plazo son de suma importancia para conocer el comportamiento, las dosis adecuadas, la prevalencia de efectos no deseados y las consecuencias del uso o mal uso en los recién nacidos. Por lo tanto, el estudio de los fármacos en la población neonatal constituye un objetivo primario para el uso adecuado, seguro y eficiente de estos fármacos.
El manejo del dolor en el recién nacido debe ser integral, individualizado y responsable, optimizar el confort y seleccionar cuidadosamente los fármacos con mayor evidencia de eficacia y seguridad.6
*Neonatóloga. Médica de planta, Área de Neonatología. Hospital de Pediatría “Prof. Dr. Juan P. Garrahan”. Ciudad Autónoma de Buenos Aires, Argentina.
** Farmacéutica clínica, Área de Nonatología. Hospital de Pediatría “Prof. Dr. Juan P. Garrahan”. Ciudad Autónoma de Buenos Aires, Argentina.
Correspondencia: crubio@garrahan.gov.ar
Recibido: 3 de octubre de 2019.
Bibliografía
1. Asociación Colombiana de Neonatología. Recomendaciones para los programas madre canguro ante la pandemia COVID-19. Segunda edición: mayo 2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/05/Consenso.-Edicio%CC%81n-2.-PROGRAMAS-MADRE-CANGURO-ANTE-LA-PANDEMIA-COVID-19.pdf.
2. Asociación Colombiana de Neonatología. Recomendaciones programas madre canguro ante la pandemia COVID-19. Primera edición, 25 de marzo de 2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf.
3. Fundación Canguro. Charpak N, Figueroa Z. Método Madre Canguro Guías de Manejo. Bogotá Colombia. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
4. Instituto Nacional de Salud: COVID-19 en gestantes y neonatos en Colombia | Boletín No. 1 | 08-07-2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
5. Sola A. Sociedad Iberoamericana de Neonatología y COVID-19 perinatal: Información y recomendaciones de SIBEN. EDISIBEN. Abril 17, 2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
6. Ministerio de Protección Social en Salud. Rutas integrales de atención en salud – RIAS 2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
7. Ministerio de Salud y Protección Social. Lineamientos provisionales para la atención en salud de las gestantes, recién nacidos y para la lactancia materna, en el contexto de la pandemia de COVID-19 en Colombia, Bogotá, Junio de 2020. [Consulta: 07-07-20]. Disponible en. https://www.minsalud.gov.co/Ministerio/Institucional/Procesos%20y%20procedimientos/GIPS14.pdf.
8. Sociedad Española de Neonatología. Manejo de la mujer embarazada y el recién nacido con COVID-19. Versión del 17 junio de 2020. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
9. Organización Panamericana de la Salud. Recomendaciones para el cuidado integral de mujeres embarazadas y recién nacidos. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf
10. Ministerio de Salud. Actualización de los lineamientos técnicos para la implementación de Programas Madre Canguro en Colombia, con énfasis en la nutrición del neonato prematuro o de bajo peso al nacer. Colombia 2017. [Consulta: 07-07-20]. Disponible en: https://scp.com.co/wp-content/uploads/2020/03/Recomndaciones-Programas-Canguro-COVID-19.pdf













