Dra. Bibiana Chinea Jiménez*, Dr. Miguel Sáenz de Pipaón Marcos**,
Gda. Silvia Ferrández Ferrández***, Dr. Jesús Díez Sebastián****
Versión en idioma español del artículo publicado en Frontiers in Pediatrics. 10:928051. doi: 10.3389/fped.2022.928051.
RESUMEN
Introducción: el objetivo principal fue describir el impacto del logro de la nutrición oral exclusiva (NOE) en recién nacidos de muy bajo peso al nacer sobre el peso, la longitud y el perímetro cefálico, medido como el cambio en el puntaje Z desde las 32 semanas hasta el alta.
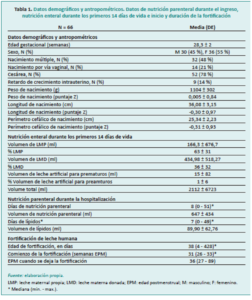
Población y métodos: estudio observacional retrospectivo longitudinal en recién nacidos menores de 30 semanas de edad gestacional, ingresados en la Unidad de Neonatología del Hospital Universitario La Paz, Madrid (España), desde el 1 de enero hasta el 31 de diciembre de 2019. Las características antropométricas del lactante se recogieron al nacer, a las 32, 34 y 36 semanas de edad gestacional, al momento de la NOE y al alta de la unidad.
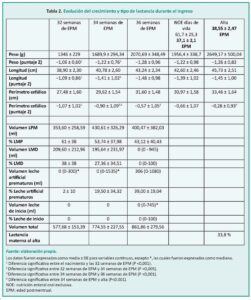
Resultados: se incluyeron un total de 66 recién nacidos. La edad gestacional al nacer osciló entre 24 y 30 semanas. La NOE se produjo a las 37,1 ± 2,1 semanas de edad posmenstrual (EPM). Se encontró una correlación inversa entre la edad gestacional y el peso al nacer con la EPM en el que se logró la NOE. La EPM al alta fue de 38,6 ± 2,5 semanas.
Conclusiones: la transición de sonda gástrica a ingesta oral no afectó el crecimiento. Encontramos una estrecha relación entre el nacimiento prematuro, antes de las 30 semanas de edad gestacional y el bajo peso al nacer, con un retraso en el logro de la NOC que se correlacionó con la edad al alta.
Palabras clave: alimentación por sonda gástrica, prematuros, enfermera, neonatología, leche humana.
ABSTRACT
Objective: The main objective was to describe the impact of full oral feeding achievement in very low birth weight infants on weight, length, and head circumference, measured as the change in z-score from 32 weeks to discharge, the time at which full oral feeding occurs.
Methods: This was a longitudinal retrospective observational study on infants younger than 30 weeks of gestational age, admitted to the Neonatology Unit of La Paz University Hospital, Madrid (Spain), from January 1, 2019 to December 31, 2019. The infant’s anthropometric characteristics (weight, height, and head circumference) were compared at birth, at 32, 34, and 36 weeks of gestational age, at the time of full oral feeding, and at discharge from the unit.
Results: A total of 66 infants were included, gestational age at birth range from 24 to 30. Full oral intake occurred at 37.1 ± 2.1 weeks of postmenstrual age (PMA). We found an inverse correlation between gestational age at birth and birth weight with PMA at which full oral feeding (FOF) is achieved. PMA at discharge was 38.6 ± 2.5 weeks. Age of full oral intake and discharge occurred later in infants who had patent ductus arteriosus, retinopathy of prematurity, and sepsis or received a blood transfusion. A positive correlation was found between days of oxygen and both parameters. However, we found no relationship between necrotizing enterocolitis or intraventricular hemorrhage with age at full oral feeding or age at discharge.
Conclusions: The transition from gastric tube to oral intake did not affect growth. We found a close relationship between preterm infant birth, earlier younger than 30 weeks of gestational age, and low birth weight, with a delay in full oral feeding achievement that correlated with age at discharge.
Keywords: gastric tube feeding, premature infants, nurse, neonatology, human milk.
Cómo citar*:
Chinea Jiménez B, Sáenz de Pipaón Marcos M, Ferrández Ferrández S, Díez Sebastián J. Influencia de la adquisición de la nutrición enteral oral total en el crecimiento de los recién nacidos prematuros. Rev Enferm Neonatal. Diciembre 2022;40:6-14.
INTRODUCCIÓN
Los recién nacidos prematuros tienen mayores necesidades nutricionales por kilogramo de peso que los recién nacidos a término y toleran menos los volúmenes elevados de líquidos.1
Los bebés prematuros fisiológicamente estables generalmente comienzan la transición de la alimentación por sonda a la alimentación oral a las 32-34 semanas de edad gestacional. Esta transición puede llevar días o semanas.2 Lograr la alimentación oral completa es un paso importante para los prematuros, ya que es un criterio de alta importante que indica la madurez y salud del prematuro.1
El éxito en la alimentación oral depende de varios factores: la madurez neurológica y fisiológica del lactante, la capacidad de concentrarse en la alimentación, organizar el funcionamiento oral-motor, coordinar la deglución con la respiración y mantener la estabilidad fisiológica.
El cuidador debe tener capacidad para regular al bebé durante la alimentación y para reconocer y responder oportunamente a las señales conductuales y fisiológicas del bebé, con el objetivo de prevenir descompensaciones fisiológicas y estrés repetido. Es especialmente importante contar con un consenso de la unidad sobre nutrición/alimentación y el protocolo nutricional.2 Algunas patologías pueden influir en las habilidades orales. En nuestra Unidad, los lactantes con ventilación invasiva, no invasiva y dependientes de CPAP permanecen alimentados por sonda.
Una revisión retrospectiva de bebés prematuros alimentados exclusivamente con leche materna nacidos con un peso <1800 g mostró una disminución en el puntaje Z de peso de 0,52 entre el nacimiento y las 35 semanas y otra disminución de 0,48 entre las 35 semanas y el alta.3 En este estudio, la transición fue a la lactancia materna y cerca del 80 % fueron dados de alta con lactancia materna, donde no se fortaleció la lactancia materna directa. La segunda disminución en el puntaje Z de peso ocurrió cuando se produjo la transición entre la sonda gástrica y la alimentación oral.
OBJETIVOS
El objetivo principal fue describir el impacto de alcanzar la NOE en prematuros de muy bajo peso al nacer sobre el peso, longitud y perímetro cefálico medido como el cambio en los puntajes Z desde las 32 semanas de EPM hasta el alta.
Los objetivos secundarios fueron:
1. Determinar cuándo se produce la transición de sonda gástrica a nutrición oral exclusiva.
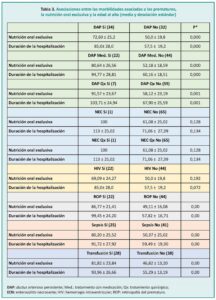
2. Evaluar el efecto del momento de la NOE sobre la duración de la estancia en el hospital y la edad al alta.
3. Analizar el efecto de la morbilidad asociada con la prematuridad con la NOE y la duración de la hospitalización o la edad al alta.
MÉTODOS
Se trata de un estudio observacional retrospectivo longitudinal en prematuros menores de 30 semanas de edad gestacional, ingresados en la Unidad de Neonatología del Hospital Universitario La Paz, Madrid (España), desde el 1 de enero de 2019 hasta el 31 de diciembre de 2019.
Muestra
La muestra del estudio incluyó a todos los recién nacidos menores de 30 semanas de edad gestacional. Se excluyó a los lactantes que presentaban anomalías congénitas o enfermedades genéticas, a los que ingresaban después de las 48 h de vida, fallecían en los primeros 7 días de vida, no estaban recibiendo nutrición enteral, tenían historia clínica incompleta o si al momento del alta estaban recibiendo alimentación por sonda gástrica.
Protocolo nutricional
Se siguieron las recomendaciones internacionales sobre nutrición precoz, comenzando con la nutrición parenteral inmediatamente al nacimiento. La nutrición enteral se introdujo en las primeras 24 h después del nacimiento. Los avances en los volúmenes de alimentación enteral se realizaron con base en los signos de tolerancia: vómitos, distensión abdominal y residuos gástricos. El objetivo de la nutrición enteral era alcanzar los 150 ml/kg/día utilizando leche materna propia (LMP) o donada (LMD) cuando no se disponía de ella.
La LMD estaba disponible para bebés nacidos con <32 semanas o <1500 g, al menos durante las primeras 3 o 4 semanas de edad posnatal o hasta que alcanzaran los 1500 g de peso, lo que ocurriera en último lugar. Una vez alcanzada la edad gestacional o el peso indicado, en caso de no haber suficiente LMP, se administró la fórmula de prematuros para recién nacidos prematuros. La fortificación estándar de la leche materna comenzó cuando la alimentación enteral alcanzó los 100 ml/kg/día y continuó hasta el alta.
La alimentación oral exclusiva se define como el momento en que se logra la ingesta total de leche del pecho o del biberón, durante 24 h.
Método estadístico
Los datos fueron procesados mediante una base de datos en formato Microsoft Excel, que posteriormente fue importada para su tratamiento estadístico en el programa SAS, versión 9.4 (SAS Institute Inc. 2013; Base SAS 9.4 SAS/STAT–Statistical analysis; Cary, NC, EE. UU.). Las diferencias estadísticamente significativas fueron aquellas que presentaron una probabilidad de error <5 % (p < 0,05). En primer lugar, se realizó una descripción de la muestra incluida en el estudio.
Como estudio piloto, no se realizó ningún análisis de cálculo de potencia. Las características antropométricas del recién nacido (peso, altura y valores absolutos del perímetro cefálico y puntaje Z) se compararon al nacer, a las 32, 34 y 36 semanas de gestacional, en el momento de la NOE y al alta de la unidad.
Estudio descriptivo
Para la descripción de las variables cuantitativas continuas se utilizó la media junto con la DE en caso de normalidad; en caso contrario, se presentó la mediana y el rango intercuartílico. Las variables cualitativas se describieron mediante frecuencias absolutas y las frecuencias relativas expresadas en porcentaje. Para algunas variables se utilizó la representación gráfica BoxPlot.
Estudio analítico
Las comparaciones entre variables cuantitativas continuas entre grupos independientes se evaluaron principalmente mediante pruebas paramétricas, utilizando la prueba t de Student cuando se compararon 2 grupos, o un análisis de varianza (ANOVA) cuando el análisis involucró a 3 o más grupos. Cuando fue necesario, se utilizaron pruebas no paramétricas, Kruskal-Wallis o Mann-Whitney U. El análisis de frecuencia entre variables cualitativas se realizó mediante la prueba de chi-cuadrado o la prueba exacta de Fisher cuando fue necesario.
El análisis de correlación entre las variables cuantitativas continuas se realizó mediante el coeficiente de correlación R de Pearson. Las variables medidas longitudinalmente (peso, longitud y perímetro cefálico y su respectivo puntaje Z) se analizaron con ANOVA de medidas repetidas, junto con la prueba de Greenhouse-Geisser. Cuando el resultado fue significativo, se utilizó la prueba post-hoc de Bonferroni para explorar todas las diferencias posibles entre dos o más puntos temporales.
CONSIDERACIONES ÉTICAS
El estudio fue aprobado por el Comité de Investigación y por el Comité Ético de Investigación Clínica del Hospital Universitario La Paz el 13 de enero de 2020 y el 20 de febrero de 2020, respectivamente. Número de aprobación HULP: PI-4009.