Lic. Marcela Arimany*
Cuidados al recién nacido con transposición de los grandes vasos
RESUMEN
La transposición de los grandes vasos es una de las cardiopatías congénitas cianóticas que cuenta con un alto impacto en el período neonatal. Requiere de asistencia y cuidados especializados para disminuir la morbimortalidad. Impone un desafío alto a los integrantes del equipo de salud para estabilizar al paciente hasta el momento de la cirugía y para el equipo quirúrgico quien deberá reparar el defecto para lograr la menor morbilidad asociada.
La recuperación postquirúrgica generalmente se realiza en centros especializados en pacientes con dichos requerimientos, pero la estabilización prequirúrgica está en manos de los profesionales de las unidades neonatales de las maternidades de nivel 3 y por eso es necesario fortalecer al equipo para lograr los mejores resultados en dicha estabilización.
El cuidado centrado en la familia en estos pacientes, es un eje prioritario para la asistencia y el seguimiento de los mismos durante toda su internación. Mantener estándares de calidad de cuidados relacionados con mejorar la seguridad de los pacientes, disminuir el riesgo de infecciones adquiridas, brindar cuidados especializados para pacientes críticos y promover la lactancia materna, es el compromiso que adquirimos al elegir ser integrantes del equipo de salud que cuida a los recién nacidos.
Palabras clave: transposición de los grandes vasos, cardiopatías congénitas cianóticas, transposición de las grandes arterias.
ABSTRACT
Transposition of the large vessels is one of the cyanotic congenital heart diseases; it has a high impact in the neonatal period and requires specialized assistance and care to reduce morbidity and mortality. It imposes a high challenge to the members of the health team to stabilize the patient until the time of surgery and for the surgical team who must repair the defect to achieve the lowest associated morbidity.
Post-surgical recovery is usually carried out in specialized centers in patients with these requirements, but pre-surgical stabilization is in the hands of the professionals of the neonatal units of level III maternity units and therefore it is necessary to strengthen the team to achieve the best results in the stabilization. Family-centered care in these patients is a priority axis for their assistance and follow-up throughout their hospitalization. Maintaining quality of care standards related to improving patient safety, reducing the risk of acquired infections, providing specialized care for critical patients and promoting breastfeeding, is the commitment we acquire by choosing to be members of the health team that cares for the newborns.
Keywords: transposition of the large vessels, cyanotic congenital heart disease, transposition of the large arteries.
Cómo citar:
Cuidados al recién nacido con transposición de los grandes vasos. Rev Enferm Neonatal. Diciembre 2019;31:5-13
INTRODUCCIÓN
En Argentina nacen por año un 1 % de recién nacidos (RN) con cardiopatías congénitas, un total aproximado de 7000 niños. El impacto que tiene este conjunto de malformaciones en la morbimortalidad neonatal e infantil, obliga a tomar conciencia sobre los cuidados especializados que se deben brindar a esta población de neonatos y sus familias.1
La transposición de los grandes vasos (TGV) o transposición de las grandes arterias, ambas formas de nombrarla en la nomenclatura nacional e internacional, comprende solamente el 2 % del total de las cardiopatías congénitas diagnosticadas en RN. Comparada con otras cardiopatías como la comunicación interventricular (CIV) o la comunicación interauricular (CIA) también es un número reducido.
A pesar de la baja incidencia, es una de las cardiopatías congénitas que mayor impacto tiene en el período neonatal. El 30 % de los RN diagnosticados y sin tratamiento mueren en la primera semana de vida y el 90 % dentro del primer año, pero, en contrapartida, si son diagnosticados y tratados en tiempo, lugar y forma cuentan con una sobrevida mayor al 90 % con grandes posibilidades de vivir una niñez, adolescencia y adultez saludable.2
Es importante comprender la patología en profundidad, aprender a interpretar sus signos, valorar el impacto que tiene para el RN y su familia y actuar en consecuencia, para brindar la gama más amplia de oportunidades para el mejor tratamiento y cuidado.
DESARROLLO
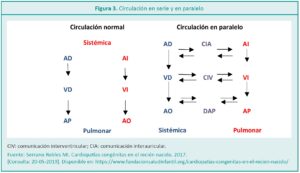
La TGV se caracteriza por tener una rotación inadecuada del tejido de formación de los vasos mayores del corazón en la vida fetal, por lo cual, de esta manera, los grandes vasos (arteria pulmonar y arteria aorta) nacen sin concordancia ventricular. También se puede definir según su anatomía como disposición espacial de los grandes vasos, situándose la aorta anteriormente y a la derecha de la arteria pulmonar (D-TGV) o anteriormente y a la izquierda de la arteria pulmonar (LTGV o TGV congénitamente corregida ya que hay una doble discordancia: aurículoventricular y ventrículo-arterial) o TGV complejas (Figuras 1 y 2).
La patología se puede presentar de dos formas: TGV sin anomalías asociadas (TGV simples) o con anomalías asociadas (Tabla 1).
Si la TGV es simple o compleja, condicionará no sólo la sobrevida del RN sino también la técnica quirúrgica y los cuidaos pre- y postquirúrgicos.
La circulación del flujo sanguíneo en la vida postnatal es en serie. La sangre llega al corazón por las venas cavas superior e inferior (VCS y VCI) a la aurícula derecha, pasa a través de la válvula tricúspide al ventrículo derecho (VD) y es eyectada por él a través de la arteria pulmonar. En los pulmones, se realiza la hematosis y regresa la sangre oxigenada por las venas pulmonares a la aurícula izquierda, pasa por la válvula mitral y el ventrículo izquierdo, y a través de la arteria aorta eyecta el flujo sanguíneo oxigenado para brindar perfusión a todos los tejidos del organismo.
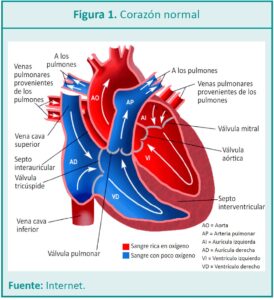
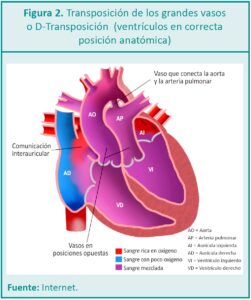
La TGV generalmente se presenta con concordancia aurículo-ventricular y con discordancia ventrículo-arterial: arteria pulmonar (AP) sobre el ventrículo izquierdo (VI) y arteria aorta (Ao) sobre el ventrículo derecho.
La anormalidad fisiológica central más importante radica en la circulación de la sangre. El retorno venoso por las venas cavas que llega a la aurícula derecha, mediante el ventrículo derecho es reenviado sin oxigenar-se a la circulación sistémica por la aorta que nace del ventrículo derecho. El retorno venoso pulmonar que llega por las venas pulmonares a la aurícula izquierda, por medio del ventrículo izquierdo es reenviado a hiperoxigenarse a los pulmones por medio de la arteria pulmonar, la cual nace del ventrículo izquierdo. De lo anterior, se deduce fácilmente que en lugar de encontrarse las circulaciones sistémicas y pulmonares conectadas en serie, lo están en paralelo (Figura 3).
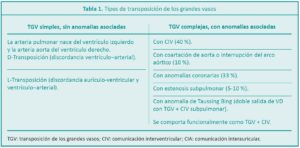
La circulación en paralelo es incompatible para la vida, por lo tanto, es indispensable que el sistema cuente con sitios de mezcla que permitan que ambos flujos sanguíneos puedan llevar sangre parcialmente oxigenada a la totalidad de los órganos. Los sitios de mezcla están dados por estructuras anatómicas que en la vida fetal son necesarias para la circulación fetal como el ductus arterioso y el foramen oval. Algunas TGV se asocian con CIV que para la fisiología de la TGV también sería de utilidad como sitio de mezcla. La presencia de estos sitios será de vital necesidad desde el nacimiento hasta el momento de la resolución quirúrgica.3,4
DIAGNÓSTICO Y VALORACIÓN CLÍNICA
Gracias a los avances de la tecnología, cada vez más las TGV se diagnostican en el periodo prenatal. La detección oportuna durante el embarazo, brinda la posibilidad de poder programar el nacimiento del RN en un centro con la complejidad adecuada para la recepción, estabilización e intervención, o la adecuada estabilización hasta el momento del traslado del RN al centro donde será intervenido quirúrgicamente.
Otro beneficio, no menos importante, es que anticipa a las familias y pueden prepararse para todo lo que tienen que enfrentar en las primeras semanas de vida de su hijo. Contar con la mayor información y comen-zar a trabajar miedos e incertidumbres, brinda herramientas para afrontar las situaciones de altísimo estrés y angustia que les tocará atravesar.5
El diagnóstico prenatal también brindará al equipo la oportunidad de organizarse y pautar cuidados y asistencia previamente planificados para la recepción del niño. La mayoría de los neonatos que nacen con diagnóstico de TGV llegan al término del embarazo sin presentar complicaciones cardiológicas en la vida fetal, ya que dicha circulación no se ve amenazada por esta malformación. El momento del nacimiento y la recepción demandarán los desafíos de estabilización y cuidado que necesita todo RN.
Presentará signos clínicos propios al proceso fisiológico de la adaptación a la vida extrauterina (transición de la circulación fetal a la circulación postnatal) con la vulnerabilidad que esto conlleva. Como expresión específica de la patología, mostrará desaturación sostenida sin signos de dificultad respiratoria, valores de desaturación que no se modifican con la administración de oxígeno suplementario (entendiendo como oxígeno suplementario el > 21 %).
Es recomendable que los niños de madres que cursan embarazos de alto riesgo o con diagnóstico prenatal de TGV, nazcan en una maternidad de complejidad 3B, ya que deberán ser internados en la sala de cuidados intensivos neonatales donde tendrán que recibir la asistencia y los cuidados necesarios que logren estabilizarlos hasta el momento de la cirugía.6
Esta patología es ductus-dependiente para el flujo sistémico. Lo más importante al comprender la patología, es saber la jerarquía que tienen los sitios de mezcla para la vida postnatal; es por eso que al contar con el diagnóstico prenatal y esperar a un neonato con esta cardiopatía, se decide que el objetivo primario del equipo será administrar prostaglandinas que favorezcan que el ductus arterioso se mantenga permeable hasta que se realice la cirugía o la septostomía por procedimiento hemodinámico. Los RN que cuenten con un foramen oval muy permeable, pueden llegar a no requerir de administración de prostaglandinas, decisión que se tomará en conjunto con los cardiólogos luego de ver la ecocardiografía.
El riesgo de no contar con diagnóstico prenatal, es que muchas veces la cianosis inicial se adjudica exclusivamente al proceso de adaptación fisiológica y el RN es trasladado junto con su madre a la internación conjunta. En el transcurso de las horas el ductus comienza a ser menos permeable. Las características del tejido ductal responden como fenómeno esperado a la disminución de las prostaglandinas endógenas, al aumento de la presión parcial de oxígeno (PaO2) y a la disminución del flujo por dicho vaso; el ductus tiende a cerrarse. El cierre fisiológico se presenta dentro de las 48 a 72 h de vida, y se completa el cierre anatómico al obliterarse alrededor del séptimo día de vida postnatal. Este proceso que para los RN sin cardiopatía congénita ductus-dependiente, es necesario y fisiológico, para los neonatos con TGV, puede llegar a ser letal si no se logra advertir el diagnóstico y se le brinda la asistencia y cuidado específico.72
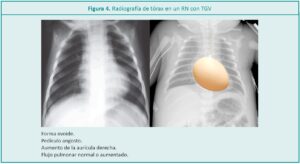
La valoración clínica juega un rol preponderante, y más en los pacientes que no cuentan con diagnóstico prenatal. Poder detectar signos clínicos precoces de insuficiencia cardíaca o colapso cardíaco disminuye la morbimortalidad dada por la patología. Se requiere la interpretación al implementar la pesquisa de cardiopatías congénitas8 y la valoración de los estudios complementarios como laboratorio y radiografía de tórax para aproximarse al diagnóstico y descartar diagnósticos diferenciales como sepsis o síndrome de dificultad respiratoria (Figura 4). Será concluyente para la definición del diagnóstico, la ecocardografía realizada por un cardiólogo, quien visualizará el defecto anatómico.
Generalmente son RN de término con adecuado peso para la edad gestacional, con buen tono muscular y buena actitud (característica prioritaria en las primeras horas antes de la disminución del flujo a través del ductus arterioso). Pueden presentar cianosis al nacimiento o cianosis moderada. Al hacerse progresiva la disminución del flujo a través del ductus, comienzan con taquipnea en progreso y demás signos de dificultad respiratoria que no ceden con el aporte de oxígeno suplementario. En el transcurso de las horas, sin haber podido detectar los signos de potencial diagnóstico, el RN comienza a desmejorar, presenta más signos de agotamiento, facies de disconfort y signos clínicos de insuficiencia cardíaca. Si no se aplica el tratamiento adecuado, al momento del cierre del ductus presentan colapso circulatorio que puede llegar a la muerte.
Es muy importante poder transmitir seguridad y brindar mucha contención a las familias de estos pacientes. Son familias que, al no contar con diagnóstico prenatal, están transitando las primeras horas posteriores al nacimiento seguramente con felicidad, y de repente cambia su realidad y su hijo presenta abruptamente una “enfermedad” que infiere riesgo de vida. La angustia y el miedo son muy grandes y esto puede traducirse como enojo o desconfianza hacia al equipo de salud. Contar con diagnóstico prenatal ayuda al equipo de salud a manejar la información con la familia. Seguramente durante el embarazo la familia ha podido acceder a información de la patología y explorar emociones que amenazaban su tranquilidad y esto fue beneficioso para poder contar con otra perspectiva luego del nacimiento. De todos modos, en ambos escenarios, el equipo de salud debe mantener una diálogo fluido, cálido y claro, y plantear con mucha seguridad hasta las incertidumbres y riesgos que impone esta cardiopatía.
ESTABILIZACIÓN PREOPERATORIA
Luego que el paciente es internado en la Unidad de Cuidados Intensivos Neonatales (UCIN), el objetivo es lograr la estabilidad hemodinámica y respiratoria. Esto no sólo le asegurará el flujo sistémico y en consecuencia mejorará la perfusión general, sino que le brindará mejores condiciones para enfrentar la cirugía o el proceso hemodinámico de septostomía previo a la cirugía si así lo necesitara. Las metas de la estabilización son: paciente normotérmico, con una saturación entre 85 % y 95 %, eupneico o con soporte de asistencia respiratoria mecánica (según necesidades ventilatorias, con valoración de los signos y síntomas de dificultad respiratoria), con buena perfusión periférica (relleno capilar < 3 segundos), valores de laboratorio dentro de los rangos de normalidad para la edad, con valores de hematocrito cercanos al 40 %. Deberá recibir cuidados organizados, con agudeza en la valoración clínica, registros de signos vitales cada dos horas y control estricto de ingresos y egresos. Los cuidados serán los cuidados estándar brindados a los RN de media o alta complejidad internados en la UCIN.
• Unidad del paciente: puede estar en incubadora o servocuna para los pacientes invadidos. En ambas opciones se deberá asegurar la termo-neutralidad.
• Monitorización: los RN con TGV deben estar con un monitor multiparamétrico, que tenga FC con onda de ECG, FR con respirograma, y controlados con saturación con onda pletismográfica, presión arterial invasiva (PAI) con onda de presión y posibilidad de presión arterial no invasiva (PANI).9
• Soporte respiratorio: dependerá de los requerimientos ventilatorios. El objetivo es disminuir el gasto metabólico. En los RN el 30 % del gasto metabólico está representado por el esfuerzo respiratorio, por lo tanto en aquellos niños que se evalúa una dificultad respiratoria grave, es criterioso pensar en la opción de la asistencia respiratoria mecánica con adecuada adaptación de sedo-analgesia. Si la dificultad respiratoria no está instalada y el RN presenta signos y facies de confort, no requerirá soporte respiratorio; sí brindar cuidados que beneficien la organización y la disminución del estrés del RN. Es muy importante que pueda realizar contacto piel a piel para lograr de esta manera mayor estabilidad.10
• Accesos vasculares: deberá contar con una vía segura para la administración de prostaglandinas, preferentemente una vía central. Puede ser un catéter umbilical venoso doble lumen o vía percutánea de doble lumen, uno independiente para el goteo de prostaglandinas y el otro para nutrición parenteral o demás medicación. Es de buena práctica contar con registro de PAI; de ser posible, colocar un catéter umbilical arterial con medición continua que además brinda la posibilidad de utilizarlo para extracciones de sangre para seguimiento de gasometría arterial y ácido láctico.11
• Aporte nutricional: podrá recibir aporte enteral por sonda orogástrica o podrá alimentarse por succión, dependiendo de su estabilidad respiratoria y su estado general. De no ser posible el aporte enteral por su evaluación clínica, se administrará nutrición parenteral (NPT). Lo más importante de este aspecto, es que se deberá tener en cuenta un adecuado aporte calórico y proteico, no sólo para cubrir las necesidades basales del neonato, sino para enfrentar el altísimo consumo energético que presupone afrontar la cirugía y los procesos de cicatrización posterior.
• Cuidado centrados en la familia: no sólo se deberá permitir que el RN esté acompañado por su familia el mayor tiempo posible, sino que se estimulará a los padres a realizar cuidados, brindar caricias, contención y el mayor contacto visual, auditivo y físico, promover el contacto piel a piel y de esta manera aumentar al máximo los canales de conexión. El período prequirúrgico puede llegar a ser el único momento donde esta familia esté unida. Los miedos a la muerte intra- y postquirúrgica impactan en los padres, no sólo acrecentados por las suposiciones sino fundamentados por la complejidad de la cardiopatía, y es por esto que debemos aprovechar al máximo esta instancia; puede llegar a ser una oportunidad única para fortalecer y beneficiar ese vínculo. Generalmente son familias con sensaciones de miedo y angustia y algunas veces hasta con imposibilidad para expresarlo. Por momentos transcurren muchas horas en silencio con escasa comunicación con el equipo. Algunas familias adoptan actitudes de desconfianza, preguntan varias veces las mismas dudas a diferentes personas, seguramente buscando una respuesta que los reconforte. Otras veces, muestran actitudes de indiferencia o de enojo hacia el equipo. Es importante entender que ninguna de las actitudes de los padres es dirigida directamente hacia los profesionales, nada es personal, es una mezcla de emociones por las que esta familia está transitando que los lleva a reacciones que pueden ser poco agradables y a menudo hostiles. Generalmente son depositadas en algunos de los integran-tes del equipo de salud sin ser la intención, perjudicar a alguno de ellos.12,13
TRATAMIENTO
Septostomía auricular
La septostomía auricular (SA) con catéter con balón de Rashkin constituye una indicación obligada en RN con distintas cardiopatías, en donde una adecuada mezcla interauricular es esencial para su supervivencia, a la espera de una cirugía correctora.
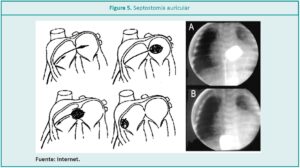
Es un procedimiento que se realiza por técnica hemodinámica, con el objetivo de garantizar un sitio de mezcla seguro que le otorgue estabilidad al paciente. La indicación más frecuente se realiza en aquellos pacientes que presentan un foramen oval (FO) restrictivo (< 50 % del tamaño del septum interauricular) y con saturación sostenida por debajo del 75 %. En algunos centros, el procedimiento se realiza en la UCIN, aunque generalmente el paciente es trasladado a la sala de hemodinamia. Los tres aspectos principales de todo traslado seguro son la estabilidad respiratoria y hemodinámica y la termorregulación,14 con todos los cuidados que impone cada aspecto. Es muy importante que la enfermera del paciente pueda acompañarlo en el tratamiento. Al llegar a la sala de hemodinamia, se lo posiciona en la mesa de procedimiento, se asegura la ventilación, las fijaciones del tubo endotraqueal, las ramas inspiratorias y espiratorias del respirador y demás tubuladuras de infusiones. El anestesista administra la dosis de sedación indicada, se posiciona al paciente y los médicos hemodinamistas realizan el procedimiento bajo técnica radioscópica. Generalmente el abordaje es por la vena femoral o también puede ser por la vena umbilical.
El catéter ingresa por el trayecto venoso hasta la AD, pasa por el FO hasta la AI donde se infla el balón de Rashkin y luego se tracciona con firmeza el catéter para romper con el balón insuflado el septum auricular para asegurar que no quede membrana que pueda cerrarlo (Figura 5).
La eficacia del tratamiento será una mejora del estado hemodinámico del paciente, con aumento de la saturación; por ecografía se puede constatar una comunicación interauricular > 5 mm. Como complicaciones, el paciente puede presentar hemopericardio, perforación de la AI, desgarro de la vena femoral, sangrado o arritmias transitorias. Dentro de los cuidados posteriores al procedimiento, se evaluará si el paciente continúa con requerimientos de prostaglandinas según la respuesta hemodinámica. Se debe evaluar el sangrado en el sito de punción y realizar compresión activa en dicha zona para evitarlo. Dentro de los cuidados de enfermería que se realizarán para la estabilización y organización del paciente al regresar a la unidad, se le administrará cuidados generales del paciente crítico y se deberán realizar registros completos no sólo de la evaluación y procedimientos realizados en la UCIN si no de la tolerancia, la respuesta y la cantidad de soluciones administradas durante el tratamiento hemodinámico.15-17
ABORDAJE QUIRÚRGICO O CIRUGÍA DE SWITCH
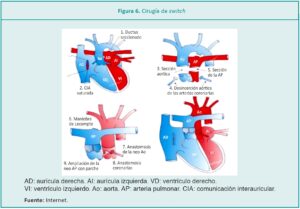
La resolución quirúrgica de esta cardiopatía es reparadora o correctora del defecto anatómico, terminología que abarca el concepto de lograr, luego de la cirugía, restablecer la fisiología y la anatomía de las estructuras cardiovasculares. Se realizará a través de esternotomía, con clampeo de los grandes vasos, circulación extracorpórea y demás técnicas quirúrgicas de patologías complejas.
La reparación consiste en reposicionar la arteria aorta en la salida del vaso que nace del ventrículo izquierdo y a la arteria pulmonar, del vaso que nace del ventrículo derecho. Para lograrlo se seccionan ambos vasos y se suturan en su posición correcta. Las arterias coronarias son las primeras arterias que nacen desde la aorta, en proximidad de la salida del ventrículo izquierdo, por tal motivo, otro de los objetivos de la cirugía es la traslocación de las mismas, que se encontraban en la aorta que nacía del ventrículo derecho, para que puedan quedar posicionadas en el sitio correcto y de esta manera asegurar adecuada perfusión miocárdica (Figura 6).
Los resultados postquirúrgicos están directamente relacionados con la experiencia y la técnica quirúrgica del equipo quirúrgico. Los neonatos sometidos a dicha cirugía, presentan, entre otras respuestas, graves complicaciones relacionadas a la respuesta inflamatoria desencadenada por la circulación extracorpórea, por lo tanto, a menor experiencia del cirujano, mayor tiempo de clampeo y de circulación extracorpórea y consecuentemente mayores efectos adversos asociados. Otro punto para tener en cuenta son los riesgos de la translocación de las arterias coronarias. Cualquier dificultad en la sutura de las mismas puede traer aparejado modificaciones en la perfusión miocárdica. A medida que el niño crece, la cicatriz de la sutura puede traccionar y hacer que la coronaria se pliegue, llegando de esta manera a la hipoperfusión o hasta la hipoperfusión grave con infarto de miocárdico y riesgo de vida.18,19
Recepción y cuidados postquirúrgicos
En relación a la recepción y cuidados postquirúrgicos de las cardiopatías congénitas, debido a la extensión y la complejidad, serán abordados en otro artículo. La descripción y la organización de los cuidados, estarán descriptos dentro un proceso pautado y detallado en función a las necesidades de los pacientes y al sustento bibliográfico.
* Licenciada en Enfermería. Coordinadora de Neonatologîa y Pediatría, Sanatorio de la Trinidad Palermo
Correspondencia: marcela.arimany@galenoargentina.com.ar
Recibido: 9 de septiembre de 2019.
Aceptado: 20 de octubre de 2019.
Bibliografía
1. Programa Nacional de Cardiopatías Congénitas (PNCC). Ministerio de Salud de la Nación. [Acceso: 20-10-2019]. Disponible en: https://www.argentina.gob.ar/salud/cardiopatiascongenitas.
2. Wernovsky G. Transposition of the Great Arteries and Common Variants. Pediatr Crit Care Med. 2016 Aug; 17(8 Suppl 1):S337-43.
3. Díaz Góngora G, Fernández O. Transposición de grandes arterias (TGA): discordancia ventriculoarterial con concordancia atrioventricular. En: Cardiología Pediátrica. 1° ed. Colombia. p.600-7.
4. Artman M, Mahony L, Teitel D. Neonatal Cardiology. 2° Ed. McGraw-Hill; USA.2012. p. 75-87.
5. Pinto NM, Weng C, Sheng X, Simon K, et al. Modifiers of stress related to timing of diagnosis in parents of children with complex congenital heart. J Matern Fetal Neonatal Med. 2016 Oct; 29(20):3340-6.
6. Ministerio de Salud de la Nación. Regionalización perinatal en la Argentina: barreras, experiencias y avances en el proceso de regionalización perinatal. – 1a ed. – Ciudad Autónoma de Buenos Aires: Ministerio de Salud de la Nación, 2018. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000001280cnt-regionalizacion-2018.pdf
7. Balestrini M, Martin A. Transposición de las grandes arterias. En: El niño con cardiopatía congénita. Ed. Fun-dación Garrahan. CABA; 2015. p. 71-88.
8. Ministerio de Salud de la Nación. Dirección Nacional de Maternidad e Infancia. Detección de Cardiopatías Congénitas por Oximetría de Pulso en recién nacidos asintomático 2015. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000726cnt-deteccion-cardiopatias.pdf.
9. Fundación Garrahan. Tópicos de Recuperación Cardiovascular Pediátrica. Hospital de Pediatría “Prof. Dr. Juan P. Garrahan” 2012.p.7.
10. Carlo W. Principios básicos de la ventilación mecánica. En Donn SM, Sinha S. Manual de asistencia respiratoria en Neonatología. 2° ed. Buenos Aires: Ediciones Journal; 2008. p. 64-76.
11. Johnson W, Moller J. Pediatric Cardiology: The Essential Pocket Guide. 3°ed. Hoboken: Wiley Blackwell; 2014.p. 186-195.
12. Altimier L, Phillips F. The Neonatal Integrative Developmental Care Model: Advanced Clinical Applications of the Seven Core Measures for Neuroprotective Family-centered Developmental Care. Newborn & Infant Nursing Reviews. 2016; 16(4):230–244.
13. Rayner M, Muscara F, Dimovski A, McCarthy MC, et al. Take A Breath: study protocol for a randomized controlled trial of an online group intervention to reduce traumatic stress in parents of children with a life threatening illness or injury. BMC Psychiatry. 2016; 16:169.
14. Ministerio de Salud de la Nación. Dirección Nacional de Maternidad e Infancia. Estabilización y traslado del recién nacido con Cardiopatía Congénita. En: Recomendaciones para la práctica del traslado neonatal. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000175cnt-n01-traslado%20neonatal.pdf.
15. Johnson W, Moller J. Pediatric Cardiology: The Essential Pocket Guide. 3°ed. Hoboken: Wiley Blackwell; 2014.p. 186 -195.
16. Balestrini M, Martin A. Transposición de las grandes arterias. En: El niño con cardiopatía congénita. Ed. Fundación Garrahan. Buenos Aires; 2015. p. 71-88.
17. Van Mater LJ, Hansen AR. Manejo respiratorio. En: Hansen AR, Puder M. Manual de cuidados intensivos en cirugía neonatal. 2° Edición. Ed. Panamericana. Buenos Aires; 2012. p. 26.
18. Turon-Viñas A, Riverola-de Veciana A, Moreno-Hernando J, Bartrons-Casas J, et al. Características y evolución de la transposición de grandes vasos en el periodo neonatal. Rev Esp Cardiol. 2014; 67(2):114-119.
19. Gil Fournier M, Álvarez A. Transposición de las grandes arterias. Servicio de Cirugía Cardiovascular. Hospital Universitario Virgen del Rocío. Sevilla. p. 351-363.













