Lic. Paulo Damián Arnaudo*
Aplicación de nuevas tecnologías en el cuidado neonatal: monitorización de la saturación regional de oxígeno
RESUMEN
En las últimas décadas, la neonatología como subespecialidad de la pediatría, ha tenido un crecimiento sustancial, dado no solo por el mayor conocimiento sobre los principales mecanismos adaptativos a la vida extrauterina y la fisiopatología de las principales entidades que afectan al recién nacido, sino por el avance de la obstetricia, la medicina fetal, perinatal y la incorporación de nuevas tecnologías al cuidado neonatal.
La tecnología NIRS (siglas en inglés de near infrared spectroscopy), o espectroscopia en la cercanía del espectro infrarrojo, es una herramienta de neuromonitorización clínica que permite realizar la medición de forma no invasiva del consumo de oxígeno en tiempo real a fin de conocer la saturación de diversos tejidos somáticos, como el cerebro, el intestino y los riñones.
Si bien los profesionales de enfermería que se desempeñan en la unidad de cuidados intensivos neonatales (UCIN) presentan un mayor desarrollo en los aspectos clínicos, terapéuticos y procedimentales, es importan-te que puedan interiorizarse en el uso de nuevos equipamientos que aportan valiosa información con el fin de optimizar el cuidado de los recién nacidos.
Este artículo aborda la historia de esta tecnología, los principios en los que se basa para su funcionamiento y los cuidados de enfermería referidos al equipamiento y al recién nacido.
Palabras clave: recién nacido, espectroscopia en la cercanía del espectro infrarrojo, perfusión tisular, cuidado neonatal.
ABSTRACT
In recent decades, neonatology as a sub-specialty of pediatrics has had substantial growth, given not only by the increased knowledge about the main adaptive mechanisms to extrauterine life and the pathophysiology of the main entities that affect the newborn, but for the advancement of obstetrics, fetal and perinatal medicine, and the incorporation of new technologies to neonatal care.
NIRS technology (near infrared spectroscopy) is a clinical neuromonitoring tool that allows non-invasive measurement of oxygen consumption in real time in order to know the saturation of various somatic tissues, such as the brain, intestine and kidneys.
Although neonatal intensive care unit (NICU) nurses have a greater development in clinical, therapeutic and procedural aspects, it is important that they can internalize themselves in the use of new equipment that provides valuable information in order to optimize newborns care.
This article addresses the history of this technology, the principles on which it is based the operating mode, and nursing care related to equipment and the newborn.
Keywords:newborn, near-infrared spectrum spectros-copy, tissue perfusion, neonatal care.
Cómo citar:
Aplicación de nuevas tecnologías en el cuidado neonatal: monitorización de la saturación regional de oxígeno. Rev Enferm Neonatal. Diciembre 2019;31:14-21
DESARROLLO
La historia de la tecnología NIRS tiene sus inicios en el siglo XIX con la transiluminación o paso de luz a través de un cuerpo, siendo Richard Brillante quien describió por primera vez esta técnica para el diagnóstico de la hidrocefalia.1
Por su parte Jobsis, en 1977, informó que el tejido absorbe la luz a partir de 700 nm (nanómetros) de longitud de onda, y que esto podía ser utilizado para la medición del tejido vital en el diámetro de 5 a 6 cm, utilizando como modelo tejido miocárdico y cerebral.
En 1985, Ferrari et al., publicaron un estudio de oximetría cerebral humana mediante NIRS y en 1986, su aplicación en el neonato pretérmino. Pero no fue hasta 1993, que se logró comercializar con aprobación de la FDA (Food and Drug Administration) un equipo capaz de monitorizar los tejidos de manera continua.2
La tecnología NIRS fue introducida como una herramienta capaz de monitorizar de manera continua y no invasiva la oxigenación de tejidos vivos, sustentada en la ley de Beer-Lambert-Bouguer, que describe la relación entre la absorción de la luz y la concentración intravascular de los cromóforos: oxihemoglobina, desoxihemoglobina y el citocromo intracelular aa3.3
La medición se realiza entre 700 y 1000 nm de longitud de onda y cada uno de estos cromóforos tienen diferentes capacidades de captación de luz. Esta ley contempla la distancia entre los sensores, el trayecto recorrido por el haz de luz y sus pérdidas por dispersión.
El pasaje de esta luz con la capacidad de atravesar la piel, el músculo y los reparos óseos como la calota, se transfiere en dos diferentes longitudes de onda que permiten detectar los cambios en la concentración de oxihemoglobina y de esta manera obtener un porcentaje de saturación regional de oxígeno (SrO2) en los tejidos a medir.
En el mercado existen diversos dispositivos que incorporan la misma tecnología, pero con diferencias en el número y valor absoluto de la longitud de onda. También existen múltiples algoritmos computacionales utilizados para traducir los cambios en la atenuación de la luz a una medida fisiológica. Por tal motivo, comparar dispositivos de diferentes fabricantes puede ser difícil.4
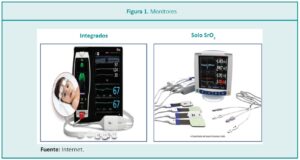
Los monitores existentes logran obtener mediciones continuas cada 5 segundos, a nivel de la circulación arterial y venosa, que evidencian el balance entre el aporte y la demanda de oxígeno a los tejidos (Figura 1).
En el mercado se encuentran disponibles sensores diseñados para recién nacidos o niños menores de 5 kg, flexibles, con adhesivo hidrocoloide y libres de látex, con la capacidad de adherirse a la piel de cualquier parte del cuerpo con interés en conocer su SrO2
Sin embargo, estos sensores neonatales miden un 10 % más que los sensores utilizados en pacientes adultos, debido a que el límite superior de la mayoría de los dispositivos se establece en el 95 %; los valores altos de oxigenación cerebral medidos por los sensores neonatales se muestran como una línea plana en la que se pierde toda la variación.5
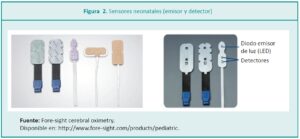
Los sensores están compuestos por un diodo de emisión de luz (LED, por las siglas de light emitting diode), que genera dos ondas de luz de un espectro cercano al infrarrojo, y dos detectores de superficie situados a una distancia mínima de 2,5 cm del foco de luz (Figura 2).
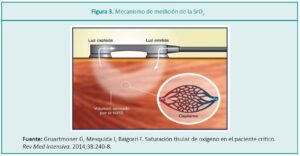
El detector proximal o superficial recibe una señal del tejido periférico y el detector distal o profundo recibe una señal de los tejidos periféricos y profundos, obteniendo una saturación regional específica a una profundidad de 1 a 2 cm, debido a la microcirculación del tejido con componentes arteriales, venosos y capilares, aunque aproximadamente el 75-85 % de la señal procede de las vénulas (Figura 3).
A diferencia de los oxímetros de pulso que proporcionan una medición de la saturación arterial de oxígeno que refleja solo el oxígeno suministrado al tejido, la tecnología NIRS refleja el equilibrio entre el suministro y la demanda de oxígeno en los tejidos locales. Por tal motivo, se lo considera un complemento de la oximetría de pulso.
Selección del sitio de medición
Mediante la tecnología NIRS se puede obtener una señal del 85 % procedente de la corteza cerebral y del 15 % del tejido extracerebral. Esta región anatómica posee territorios de perfusión de las arterias cerebrales anterior y media, y es particularmente vulnerable al déficit en el aporte de oxígeno.
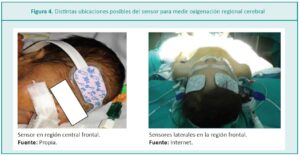
El sitio de aplicación más frecuente es en la frente del paciente, con el fin de medir el equilibrio entre la entrega de oxígeno y la utilización en la materia gris de la región frontal (cSrO2).
Cuando el sensor se aplica en el centro, al nivel de la línea media, se obtiene una medición regional más global. Esta recomendación también aplica para la monitorización en el recién nacido pretérmino (RNPT), debido a la escasa superficie disponible para la colocación del sensor (Figura 4).
Si bien generalmente se utiliza un sensor, existe la recomendación de colocar un sensor a cada lado de la línea media, intentando evitar el seno sagital superior con el fin de conocer la oxigenación diferenciada de cada hemisferio cerebral, aportando una valiosa información en pacientes con el polígono de Willis incompleto, que ocurre en el 5 % de los neonatos.
Dentro de las posibilidades y en el caso de poseer diagnóstico previo, es importante la aplicación del sensor en zonas alejadas de nevos, cavidades sinusales, hematomas subdurales, epidurales y malformaciones arteriovenosas.6
La correcta medición del sensor puede variar dependiendo de las características del cráneo, las estructuras extracraneales, el flujo sanguíneo y la profundidad de la superficie cerebral.
En los RN pueden realizarse mediciones de la oxigenación regional de órganos más profundos, como los riñones (rSrO2) e intestinos (sSrO2), mediante el conocimiento de la perfusión renal, mesentérica y esplácnica respectivamente (Figuras 5 y 6).7
Existen reportes que indican que esta tecnología puede predecir el desarrollo de enterocolitis necrotizante (ECN), además de oficiar como guía para el inicio de la alimentación enteral en los RNPT.8
Este equipamiento permite también medir la oxigenación de los tejidos periféricos (pSrO2), como el ante-brazo, la pantorrilla, la parte superior del brazo y el muslo. Se recomienda evitar la colocación del sensor sobre depósitos grasos, hematomas, nevos y lesiones dérmicas, ya que puede generar lecturas erráticas.
Es de vital importancia conocer que estos sensores no producen quemaduras, aun con el uso a largo plazo del dispositivo, por lo tanto no es necesario su recambio o rotación, excepto en los casos de errores de lectura o disminución de la capacidad adhesiva del sensor.
Valores de referencia en la SrO2
En la actualidad existe evidencia que demuestra los cambios de la saturación regional de oxígeno en diferentes etapas posnatales. Se han encontrado valores entre el 40-56 % luego del nacimiento, con incremento luego de los 15 minutos de vida en forma independiente del modo de parto, el 78 % a las 48 horas y la estabilización entre el 55-85 % a las 3 a 6 semanas de vida.9
Un estudio reciente de Alderliesten et al., proporciona valores de referencia basados en una gran cohorte de estudio durante las primeras 72 horas de vida en recién nacidos pretérmino menores de 32 semanas de edad gestacional. Este estudio demostró que los sensores utilizados de diferentes fabricantes ofrecían valores hasta un 10 % más elevados en comparación con los sensores para adultos.10
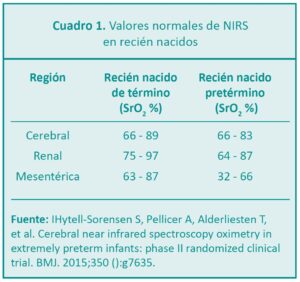
Los valores normales de la SrO2 se encuentran entre el 50-70 % en niños y el 58-82 % en adultos, considerándose desaturaciones cerebrales las cifras inferiores al 50 % en valor absoluto durante un período prolongado, inferiores al 40 % en valor absoluto durante un período corto de tiempo o una disminución relativa de un 20 % respecto a los valores basales. Los valores superiores al 85-90 % de SrO2 son sugestivos de hiper-flujo cerebral o disminución del metabolismo cerebral (Cuadro 1).
Son de gran importancia las tendencias y las variaciones respecto al valor basal, existiendo variaciones entre cada paciente con respecto a los valores basales.
El valor basal sería el valor medido de SrO2, con el paciente en reposo o anestesiado con estabilidad hemodinámica, cifras normales de hemoglobina, oxigenación adecuada, en normocapnia y normotermia. Los cambios del valor basal están relacionados con estas variables y por lo tanto, actuando sobre dichas variables se puede optimizar la perfusión-oxigenación cerebral.11
Aplicaciones clínicas
El uso de esta tecnología ha sido estudiada en cerdos, indicando una correlación entre el daño mitocondrial irreversible y la interrupción de la energía total entre los 30 y 120 minutos con valores que oscilan entre el 33-45 %.12
Si bien las aplicaciones se realizan en todas las etapas de la vida, es de especial utilidad en los RNPT, debido a la relación existente entre la inmadurez de la autorregulación del flujo cerebral y los drásticos cambios hemodinámicos, que los dejan vulnerables a la lesión vascular cerebral. Por lo tanto es prioritario su uso, combinado con otros dispositivos de monitoreo cerebral como el EEGa (electroencefalograma de amplitud integrada).13
Además de las mencionadas, existe evidencia disponible del uso de la tecnología NIRS en diversas instancias terapéuticas, como ser durante la transición a la vida extrauterina, la reanimación cardiopulmonar, en pacientes con cardiopatías congénitas, neonatos en cirugía cardiovascular, RN con encefalopatía hipóxico-isquémica y durante la oxigenación por membrana extracorpórea. También durante diversas enfermedades del RNPT como ser el síndrome de dificultad respiratoria, ductus arterioso permeable, hemorragia intracraneana, apneas y durante procedimientos como la transfusión de glóbulos rojos.
RECOMENDACIONES TÉCNICAS PARA ENFERMERÍA
• Verificar la correcta conexión del equipo y del cable paciente.
• Corroborar la posición de los canales y los sensores correspondientes para evitar confusiones en las lecturas
• Verificar los datos del paciente y las alarmas del monitor.
• Verificar la adecuada posición del sensor, la adhesividad y permanencia de la luz. Si la luz titila, aparece y desaparece el valor o es muy diferente del basal, se recomienda cambiar el sensor.
• No reemplazar el sensor a menos que sea necesario según los puntos antes mencionados. Puede ocasionar lesiones en la piel, con más frecuencia en el RNPT y en ocasiones imposibilita la colocación de otro sensor en el mismo sitio debido al daño tisular.
• Tener en cuenta los parámetros de referencia y comunicar al médico las variaciones en correlación con el resto de la monitorización utilizada, como la saturación de oxígeno (SatO2), medición transcutánea de dióxido de carbono (tCO2) y EEGa.
RECOMENDACIONES PARA ENFERMERÍA ANTE EVENTOS CLÍNICOS QUE PUEDEN DISMINUIR LA cSrO2
• Ductus arterioso persistente: cuando esta patología genera descompensación hemodinámica e hiperflujo pulmonar por el shunt de izquierda a derecha, el equipo médico puede indicar el tratamiento farmacológico, y ante su fracaso, recurrir a la corrección quirúrgica.
Enfermería debe verificar la correcta monitorización hemodinámica, valorar la presencia de pulsos y precordio activo, realizar los cuidados farmacológicos y colaborar en el perioperatorio.
• Hipotensión: generalmente los RNPT no responden en forma adecuada a las expansiones con cristaloides debido a la inmadurez de las fibras musculares cardíacas, dificultando la optimización de la precarga o llenado ventricular.
En el caso que se indique de igual manera, la misma debe efectuarse en 10 minutos para no generar una rápida sobrecarga de volumen a nivel sistémico, que pude repercutir a nivel vascular cerebral.
Ante la indicación médica de administrar drogas inotrópicas o vasoactivas, enfermería debe realizar los cuidados farmacológicos correspondientes a este tipo de medicamentos.
• Aumento de la PEEP (presión espiratoria al final de la espiración): controlar la estabilidad de los parámetros en pacientes con ventilación mecánica o CPAP (presión positiva continua en la vía aérea). Tener presente que el exceso de PEEP puede disminuir el retorno venoso cardíaco, afectar la precarga y disminuir la perfusión sistémica, pulmonar y cerebral. Comunicar al médico para la revaloración del paciente y su tratamiento.
• Hipocapnia: es importante tener en cuenta que esta situación genera vasoconstricción vascular cerebral, afecta la perfusión de este órgano y en el monitoreo se observa baja cSrO2. Tener en cuenta que a mayor frecuencia respiratoria, mayor eliminación de CO2.
Enfermería debe valorar al paciente en busca de signos de estrés y dolor que pueden generar hiper-ventilación, que provoca el descenso de la CO2.
Comunicar al equipo médico para la revaloración del paciente y su tratamiento.
• Anemia: en este caso puede encontrarse disminuido tanto el valor eritrocitario como la concentración de hemoglobina. La disminución de esta última disminuye el transporte de oxígeno a los tejidos.
Enfermería debe valorar al paciente, el color de piel y de las mucosas y el aumento de los requerimientos de oxígeno. Comunicar estos datos al médico para verificar el requerimiento o no de una transfusión de glóbulos rojos.
• Disminución de la SatO2: existe una correlación entre la SatO2 y la SrO2. Establecer con el equipo médico los rangos de cada uno y cómo actuar ante la disminución de estos valores. No siempre la disminución de la cSrO2 se revierte con el incremento de la fracción inspirada de oxígeno (FIO2).
Enfermería debe tener presente los rangos de SatO2 seguros según las recomendaciones del Ministerio de Salud de la Nación (SatO2 entre el 89-94 % con alarmas en el 88 % y el 95 %).
Si bien el oxígeno posee efecto vasodilatador, es importante recordar que administrado a altas concentraciones y de manera crónica puede generar lesiones en diversos tejidos en relación al estrés oxidativo celular y la liberación de radicales libres.
• Rotación cefálica: la rotación axial de la cabeza pue-de provocar una compresión de la arteria carótida interna contralateral antes de su entrada en la base del cráneo y provocar una disminución del flujo sanguíneo cerebral, disminuyendo la cSrO2.
Enfermería debe favorecer una postura adecuada con preferencia en la línea media. Ante la necesidad de realizar cambios de decúbito y/o rotación cefálica, será de manera gentil y unimodal (en dos tiempos) evitando la lateralización excesiva, con el fin de prevenir el hipoflujo cerebral.
RECOMENDACIONES PARA ENFERMERÍA ANTE EVENTOS CLÍNICOS QUE PUEDEN AUMENTAR LA cSrO2
• Hipercapnia: ante estos eventos se produce vasodilatación vascular cerebral, con el riesgo de generar un impacto negativo en los RNPT, más susceptibles debido a la inmadurez en la autorregulación del flujo sanguíneo cerebral. Se manifestará con aumento de la cSrO2.
Enfermería debe optimizar la entrega de gases y verificar la permeabilidad del tubo endotraqueal mediante la auscultación y, de ser necesario, la aspiración de secreciones para disminuir la retención de CO2. Tener en cuenta que a menor frecuencia respiratoria, menor eliminación de CO2
Es importante consensuar con el equipo médico los valores de la pCO2 ante la decisión de hipercapnia permisiva.
• Aumento de la SatO2: disminuir la FIO2 de acuerdo a las recomendaciones enunciadas anteriormente. Evitar los episodios de hiperoxia.
• Hipoglucemia: mantener valores adecuados de glucemia asegura un aporte energético adecuado para el metabolismo celular de los tejidos cerebrales.
• Hipotermia: los pacientes sometidos a hipotermia terapéutica o iatrogénica presentan una disminución en el consumo de oxígeno cerebral, traducido en valores incrementados de cSrO2, mientras que a temperaturas más elevadas la utilización de oxígeno cerebral es mucho mayor.
Enfermería tendrá como objetivo lograr un ambiente térmico neutro con el fin de mantener equilibrado el gasto metabólico y el consumo de oxígeno.
CONCLUSIONES
La implementación de nuevas tecnologías en función de la mejora en el cuidado neonatal enfrenta al equipo interdisciplinario con la necesidad de capacitarse en forma continua. En este artículo se abordaron consideraciones concernientes a las bases para el funcionamiento de la tecnología NIRS, los equipos, los sensores, los valores de referencia y su interpretación en relación a las condiciones clínicas que pueden presentar los recién nacidos con el fin de optimizar su cuidado.
El conocimiento enfermero sobre sus aspectos fisio-patológicos y clínicos confiere un valor significativo a la hora de poder incorporar la información que brinda esta tecnología contribuyendo al cuidado seguro y basado en la mejor evidencia disponible para la salud de los recién nacidos.
* Especialista en Enfermería Neonatal. Enfermero asistencial del Servicio de Neonatología del Hospital Italiano de Buenos Aires. Profesor de la carrera de Especialista en Enfermería Neonatal. Universidad Austral
Contacto: arnaudopaulo80@gmail.com
Recibido: 1 de noviembre de 2018.
Aceptado: 1 de agosto de 2019.
Bibliografía
1. Programa Nacional de Cardiopatías Congénitas (PNCC). Ministerio de Salud de la Nación. [Acceso: 20-10-2019]. Disponible en: https://www.argentina.gob.ar/salud/cardiopatiascongenitas.
2. Wernovsky G. Transposition of the Great Arteries and Common Variants. Pediatr Crit Care Med. 2016 Aug; 17(8 Suppl 1):S337-43.
3. Díaz Góngora G, Fernández O. Transposición de grandes arterias (TGA): discordancia ventriculoarterial con concordancia atrioventricular. En: Cardiología Pediátrica. 1° ed. Colombia. p.600-7.
4. Artman M, Mahony L, Teitel D. Neonatal Cardiology. 2° Ed. McGraw-Hill; USA.2012. p. 75-87.
5. Pinto NM, Weng C, Sheng X, Simon K, et al. Modifiers of stress related to timing of diagnosis in parents of children with complex congenital heart. J Matern Fetal Neonatal Med. 2016 Oct; 29(20):3340-6.
6. Ministerio de Salud de la Nación. Regionalización perinatal en la Argentina: barreras, experiencias y avances en el proceso de regionalización perinatal. – 1a ed. – Ciudad Autónoma de Buenos Aires: Ministerio de Salud de la Nación, 2018. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000001280cnt-regionalizacion-2018.pdf
7. Balestrini M, Martin A. Transposición de las grandes arterias. En: El niño con cardiopatía congénita. Ed. Fun-dación Garrahan. CABA; 2015. p. 71-88.
8. Ministerio de Salud de la Nación. Dirección Nacional de Maternidad e Infancia. Detección de Cardiopatías Congénitas por Oximetría de Pulso en recién nacidos asintomático 2015. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000726cnt-deteccion-cardiopatias.pdf.
9. Fundación Garrahan. Tópicos de Recuperación Cardiovascular Pediátrica. Hospital de Pediatría “Prof. Dr. Juan P. Garrahan” 2012.p.7.
10. Carlo W. Principios básicos de la ventilación mecánica. En Donn SM, Sinha S. Manual de asistencia respiratoria en Neonatología. 2° ed. Buenos Aires: Ediciones Journal; 2008. p. 64-76.
11. Johnson W, Moller J. Pediatric Cardiology: The Essential Pocket Guide. 3°ed. Hoboken: Wiley Blackwell; 2014.p. 186-195.
12. Altimier L, Phillips F. The Neonatal Integrative Developmental Care Model: Advanced Clinical Applications of the Seven Core Measures for Neuroprotective Family-centered Developmental Care. Newborn & Infant Nursing Reviews. 2016; 16(4):230–244.
13. Rayner M, Muscara F, Dimovski A, McCarthy MC, et al. Take A Breath: study protocol for a randomized controlled trial of an online group intervention to reduce traumatic stress in parents of children with a life threatening illness or injury. BMC Psychiatry. 2016; 16:169.
14. Ministerio de Salud de la Nación. Dirección Nacional de Maternidad e Infancia. Estabilización y traslado del recién nacido con Cardiopatía Congénita. En: Recomendaciones para la práctica del traslado neonatal. [Acceso: 20-10-2019]. Disponible en: http://www.msal.gob.ar/images/stories/bes/graficos/0000000175cnt-n01-traslado%20neonatal.pdf.
15. Johnson W, Moller J. Pediatric Cardiology: The Essential Pocket Guide. 3°ed. Hoboken: Wiley Blackwell; 2014.p. 186 -195.
16. Balestrini M, Martin A. Transposición de las grandes arterias. En: El niño con cardiopatía congénita. Ed. Fundación Garrahan. Buenos Aires; 2015. p. 71-88.
17. Van Mater LJ, Hansen AR. Manejo respiratorio. En: Hansen AR, Puder M. Manual de cuidados intensivos en cirugía neonatal. 2° Edición. Ed. Panamericana. Buenos Aires; 2012. p. 26.
18. Turon-Viñas A, Riverola-de Veciana A, Moreno-Hernando J, Bartrons-Casas J, et al. Características y evolución de la transposición de grandes vasos en el periodo neonatal. Rev Esp Cardiol. 2014; 67(2):114-119.
19. Gil Fournier M, Álvarez A. Transposición de las grandes arterias. Servicio de Cirugía Cardiovascular. Hospital Universitario Virgen del Rocío. Sevilla. p. 351-363.













